
【题目】已知Ca(OH)2和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小。在钨冶炼工艺中,将氢氧化钙加入钨酸钠碱性溶液中得到钨酸钙,发生反应Ⅰ:WO42—(aq)+ Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)。
CaWO4(s)+2OH-(aq)。
(1)如图为不同温度下Ca(OH)2、CaWO4的沉淀溶解平衡曲线。

①计算T1时Ksp(CaWO4)=________。
②T1________T2(填“>”、“=”或“<”)。
(2)反应Ⅰ的平衡常数K理论值如表所示:
温度/℃ | 25 | 50 | 90 | 100 |
K | 79.96 | 208.06 | 222.88 | 258.05 |
①该反应平衡常数K的表达式为________________。
②该反应的ΔH________0(填“>”、“=”或“<”)。
③由于溶液中离子间的相互作用,实验测得的平衡常数与理论值相距甚远。50℃时,向一定体积的钨酸钠碱性溶液[c(Na2WO4)=c(NaOH)=0.5mol·L-1]中,加入过量Ca(OH)2,反应达到平衡后WO42—的沉淀率为60%,计算实验测得的平衡常数________________。
(3)制取钨酸钙时,适时向反应混合液中添加适量盐酸,分析作用: __________________。
【答案】1×10-10 < c2(OH—)/c(WO42—) > 6.05 加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42—的沉淀率
【解析】
(1)①根据图像,T1时KSP(CaWO4)=c(Ca2+)c(WO42-)=1×10-5×1×10-5=1×10-10,故答案为:1×10-10;
②根据题意,Ca(OH)2和钨酸钙(CaWO4)都是微溶电解质,两者的溶解度均随温度升高而减小,即温度越高,Ksp越小,根据图像可以看出T1的Ksp较大,所以T1<T2,故答案为:<;
(2)①反应平衡常数K等于生成物平衡浓度系数次方之积和反应物平衡浓度系数次方之积,即K=![]() ,故答案为:
,故答案为:![]() ;
;
②根据表中温度和K之间的关系,可以看出温度越高,K越大,说明升高温度,平衡正向移动,所以正反应是吸热反应,ΔH>0,故答案为:>;
③ WO42-(aq)+Ca(OH)2(s)═CaWO4(s)+2OH-(aq)
起始/molL-1 0.5 0.5
变化/molL-10.5×60%=0.3 0.6
平衡/molL-1 0.2 1.1
K=![]() =
=![]() =6.05(molL-1),故答案为:6.05;
=6.05(molL-1),故答案为:6.05;
(3)向反应混合液中添加适量盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,这样可以提高WO42-的沉淀率,故答案为:加入盐酸,消耗反应生成的OH-,使溶液中OH-浓度减小,平衡向正反应方向移动,提高WO42-的沉淀率。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组内物质反应产生的气体分别通入FeSO4溶液中,能与FeSO4发生反应的是( )
A.MnO2与浓盐酸共热B.Al与NaOH溶液
C.食盐和浓硫酸共热D.铜片和浓硫酸共热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应:Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
(1)A物质可以使酸性KMnO4溶液___________(实验现象)。反应中的还原剂是____________(化学式)。
(2)一定量的铜片与100mL18mol/L 的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为_________g, 生成的A气体在标准状况下的体积为_________L(假设气体全部逸出)。
(3)将反应后所得到的溶液与足量Ba(OH)2溶液充分反应,所得沉淀为混合物,其中硫酸钡的质量为______g。(保留到0.1g,不要求计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“一硝二磺三木炭”,是一种古老的火药配制方法,在我国唐代炼丹家孙思邈的《丹经内伏硫黄法》中就有记载。这里的“硝”是某种硝酸盐,其中含有的元素是
A.氮B.氢C.氯D.磷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2(g)+3H2(g)![]() 2NH3(g)。该可逆反应达到平衡的标志是________。
2NH3(g)。该可逆反应达到平衡的标志是________。
A.3v正(H2)=2v逆(NH3) B.单位时间生成m mol N2的同时生成3m mol H2
C.容器内的总压强不再随时间而变化 D.混合气体的密度不再随时间变化
(2)工业上可用天然气为原料来制取合成氨的原料气氢气。某研究性学习小组的同学模拟工业制取氢气的原理,在一定温度下,体积为2 L的恒容密闭容器中测得如下表所示数据。请回答下列问题:
时间/min | CH4/mol | H2O/mol | CO/mol | H2/mol |
0 | 0.40 | 1.00 | 0 | 0 |
5 | a | 0.80 | c | 0.60 |
7 | 0.20 | b | 0.20 | d |
分析表中数据,判断5 min时反应是否处于平衡状态?______(填“是”或“否”),前5 min反应的平均反应速率v(CH4)=____________________。
(3)恒温恒容下,将2 mol 气体A和2 mol气体B通入体积为2L的密闭容器中,发生如下反应:2A(g)+B(g) xC(g)+2D(s),2 min后反应达到平衡状态,此时剩余1.2 mol B,并测得C的浓度为1.2 mol/L。
①x=________。
②A的转化率与B的转化率之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:某校课外小组同学制备Fe(OH)3胶体,并研究该胶体的性质。
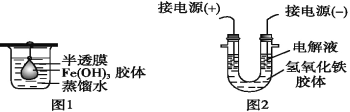
(1)该小组同学采用了以下操作制备胶体,请将空白处填写完整。
取一个烧杯,加入20 mL蒸馏水,加热至沸腾,然后向烧杯中滴加1~2 mL饱和______溶液,继续煮沸,待溶液呈____后,停止加热。
(2)将制得的胶体放入半透膜制成的袋内,如图1所示,放置2 min后,取少量半透膜外的液体于试管中,置于暗处,用一束强光从侧面照射,观察_____(填“有”或“无”)丁达尔效应;再向烧杯中加入用稀硝酸酸化的硝酸银溶液,可观察到的现象为______________。
(3)将半透膜内的液体倒入U形管中,如图2所示,在液体上方加入少量电解液以保护胶体,接通直流电后,观察到的现象是____(填“阴”或“阳”)极附近颜色逐渐变深,其原因是_______。
II:回答下列问题:
(1)“铝热反应”中的铝热剂通常是Fe2O3和Al粉的混合物,高温反应时可放出大量的热。请写出该反应的化学方程式_________________________。
(2)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。FeCl3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液与氨水反应:Al3++3OH-![]() Al(OH)3↓
Al(OH)3↓
B. 氧化镁与稀盐酸反应:MgO+2H+![]() Mg2++H2O
Mg2++H2O
C. 铜与氯化铁溶液反应:2Fe3++3Cu![]() 2Fe+3Cu2+
2Fe+3Cu2+
D. 稀硫酸与氢氧化钡溶液反应:SO42-+Ba2+![]() BaSO4↓
BaSO4↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国NASA曾开发一种铁—空气二次电池。该电池放电时,其原理如下图所示,电池反应为:2Fe+O2+2H2O===2Fe(OH)2。
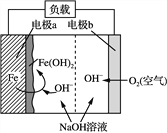
有关该电池放电时的说法正确的是( )
A. a极质量不变
B. b极为电池负极
C. 电子由a极经负载流向b极
D. 由电能转变为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究人员研制出一种可作为鱼雷和潜艇的储备电源的新型电池——锂水电池(结构如图),使用时加入水即可放电。下列关于该电池的说法不正确的是( )
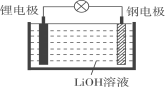
A. 锂为负极,钢为正极B. 工作时负极的电极反应式为Li-e-=Li+
C. 工作时OH-向钢电极移动D. 放电时电子的流向:锂电极→导线→钢电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com