
【题目】在容积一定的密闭容器中,可逆反应A(g)+B(g)![]() xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
xC(g),有如图所示的关系曲线,根据如图下列判断正确的是( )
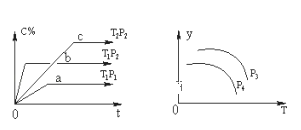
A.p3>p4,y轴表示A的物质的量分数
B.若增大A的浓度,平衡体系颜色加深,C一定是有颜色的气体
C.p3<p4,y轴表示平衡常数K
D.p3>p4,y轴表示混合气体的平均摩尔质量
【答案】D
【解析】
由左图中折线的斜率,可知p2>p1 ,T1>T2,因为压强越大,温度越高,化学反应速率越快。由左图中a、b的相对位置知,增压(因p2>p1),w(C)升高,说明增压,平衡正向移动,则正反应是气体体积减小的反应,故x=1;由b、c的相对位置知,升温(因为T1>T2),w(C)降低.说明升高温度,逆向移动,故正反应为放热反应。即该反应为:A(g)+B(g)![]() C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动。
C(g)(正反应为放热反应),由反应式可知,升温和降压均可使反应向逆反应方向移动。
由右图可知,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,结合压强对平衡移动的影响判断p3、p4的关系。
由以上分析可知该反应为:A(g)+B(g)![]() C(g)(正反应为放热反应),
C(g)(正反应为放热反应),
A. 增大压强,平衡正向移动,A的物质的量分数应减小,故A错误;
B. 若增大A的浓度,平衡体系颜色加深,有颜色的气体也可能为A,故B错误;
C. 温度不变,则平衡常数不变,不受压强的影响,故C错误;
D. 由右图可知,y随温度的升高而降低,可判断y为A的转化率或混合气体的平均摩尔质量等量,p3>p4,说明增大压强,y值增大,则y轴表示混合气体的平均摩尔质量,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】某实验小组用100mL0.50mol/LNaOH溶液与60mL0.50mol/L硫酸进行中和热的测定。装置如图所示,回答下列问题:
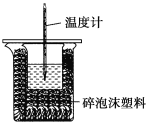
(1)若实验共需要400mLNaOH溶液,实验室在配制该溶液时,则需要称量NaOH固体____g。
(2)图中装置缺少的仪器是____。
(3)硫酸稍过量的原因是____。
(4)请填写下表中的平均温度差:
实验 次数 | 起始温度T1/℃ | 终止温度 T2/℃ | 平均温度差 (T2-T1)/℃ | ||
HCl | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | ____ |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(5)近似认为0.50 mol/L NaOH溶液与0.50 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比热容为c=4.18J/(g℃)则上述实验中和热ΔH=___(取小数点后一位)
(6)上述实验结果与57.3kJ/mol有偏差产生偏差的原因可能是____
A.量取NaOH溶液时仰视读数
B.为了使反应充分,可以向酸中分次加入碱
C.实验装置保温隔热效果差
D.用铜丝代替玻璃棒搅拌
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法正确的是( )
A. 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
B. 室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣离子数目为0.1NA
C. 氢氧燃料电池正极消耗22.4 L(标准状况)气体时,电路中通过的电子数目为2NA
D. 5NH4NO3![]() 2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
2HNO3+4N2↑+9H2O反应中,生成28 g N2时,转移的电子数目为3.75NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是( )
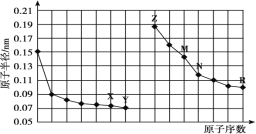
A.最高价氧化物对应水化物的碱性:Z<M
B.Y、R两种元素气态氢化物的稳定性:Y>R
C.X、N两种元素形成的化合物属于离子化合物
D.简单离子的半径:Z>M>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是有关钠与水反应及产物检验的实验装置。实验开始时先向管内加入滴有酚酞试液的水,使水位达到B端管口,然后迅速塞紧橡胶塞并拔掉大头针,此时Na掉入水中。回答下列问题:
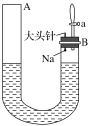
(1)钠与水反应的化学方程式为_____________。
(2)钠与水反应的现象有很多,不同的现象证明不同的性质。
①能证明钠的密度比水小的现象是_________。
②能证明钠的熔点低的现象是_________。
③能证明有氢氧化钠生成的现象是__________。
④能证明有气体产生的现象是A端液面________(填“上升”“下降”或“不变”,下同),B端液面________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.24g镁与27g铝中,含有相同的质子数
B.同等质量的氧气和臭氧中,氧原子数相同
C.1mol/L NaOH溶液中,含Na+数目为NA
D.标准状况下,NA个四氯化碳分子所占的体积约为22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列有关说法正确的是( )
A.1L0.1molL-1NaNO2溶液中NO2-的数目为0.1NA
B.3.1g乙二醇中含有羟基的数目为NA
C.5.85gNa37Cl中所含质子总数为2.8NA
D.2.4g镁条在足量的由N2和O2组成的混合气体中完全燃烧时,转移的电子总数一定为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一块金属钠露置于空气中,观察到下列现象:金属钠银白色![]() 变灰暗
变灰暗![]() 变白色
变白色![]() 表面潮湿
表面潮湿![]() 形成白色晶体
形成白色晶体![]() 形成白色粉末。据此判断下列说法中不正确的是( )
形成白色粉末。据此判断下列说法中不正确的是( )
A.过程⑤最终形成的白色粉末是![]()
B.过程④是氢氧化钠溶液吸收空气中的![]() 、水蒸气形成了碳酸氢钠晶体
、水蒸气形成了碳酸氢钠晶体
C.过程③中,是因为氢氧化钠具有很强吸湿性,吸收空气中的水分子,最后会完全溶解成溶液
D.整个变化过程中只有一个氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com