
【题目】固定容积为2 L的密闭容器中发生反应xA(g)+yB(g) ![]() zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
zC(g),图1表示T ℃时容器中各物质的量随时间变化的关系,图2表示平衡常数K随温度变化的关系。结合图像判断,下列结论正确的是( )
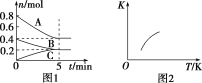
A.该反应可表示为2A(g)+B(g) ![]() C(g) ΔH<0
C(g) ΔH<0
B.T ℃时该反应的平衡常数K=6.25
C.当容器中气体密度不再变化时,该反应达到平衡状态
D.T ℃,在第6 min时再向体系中充入0.4 mol C,再次达到平衡时C的体积分数大于0.25
【答案】D
【解析】
A.由图1可知A、B为反应物C为生成物,A的物质的量的变化量为0.4mol,B的物质的量的变化量为0.2mol,C的物质的量的变化量为0.2mol,根据物质的量的变化量之比等于化学计量数之比书写方程式;由图2可知,升高温度,平衡常数增大,可知该反应为吸热反应;
B. 根据三段法有
2A(g) + B(g) ![]() C(g)
C(g)
始(mol/L) 0.4 0.2 0
转(mol/L) 0.2 0.1 0.1
平(mol/L) 0.2 0.1 0.1
根据平衡常数K=![]() 进行计算;
进行计算;
C. 容器内气体的质量保持不变,容器的容积保持不变,密度始终不变;
D. 第6 min时再向体系中充入0.4 mol C,相当于加压,平衡正向移动。
A.由图2知,升高温度,平衡常数逐渐增大,该反应为吸热反应,ΔH>0,A项错误;
B.根据图1知0~5 min内,A、B、C变化的物质的量分别为0.4 mol、0.2 mol、0.2 mol,该反应可表示为2A(g)+B(g) ![]() C(g),反应达到平衡时A、B、C的平衡浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.1 mol·L-1,故T ℃时该反应的平衡常数K=
C(g),反应达到平衡时A、B、C的平衡浓度分别为0.2 mol·L-1、0.1 mol·L-1、0.1 mol·L-1,故T ℃时该反应的平衡常数K= =25,B项错误;
=25,B项错误;
C.根据质量守恒定律知,容器内气体的质量保持不变,容器的容积保持不变,故容器内气体的密度为恒量,不能作为平衡标志,C项错误;
D.根据图1知T ℃时反应达平衡后C的体积分数为0.25,在第6 min时再向体系中充入0.4 mol C,相当于加压,平衡正向移动,再次达到平衡时,C的体积分数大于0.25,D项正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】在相同温度下(T=500K),有相同体积的甲、乙两容器,且保持体积不变,甲容器中充入1gSO2和1gO2,乙容器中充入2gSO2和2gO2。下列叙述中错误的是( )
A.化学反应速率:乙>甲B.平衡时O2的浓度:乙>甲
C.平衡时SO2的转化率:乙>甲D.平衡时SO2的体积分数:乙>甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL ![]() 溶液中滴加
溶液中滴加![]() 的
的![]() 溶液,滴加过程中,溶液中
溶液,滴加过程中,溶液中![]() 与
与![]() 溶液体积(V)的关系如图所示,下列说法正确的是( )已知:
溶液体积(V)的关系如图所示,下列说法正确的是( )已知: ![]() 。
。

A. 该温度下 ![]()
B. X、Y、Z三点中,Y点水的电离程度最小
C. ![]() 溶液中:
溶液中:![]()
D. 向100 mL ![]() 浓度均为
浓度均为![]() 的混合溶液中逐滴加入
的混合溶液中逐滴加入![]() 的
的![]() 溶液,
溶液,![]() 先沉淀
先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在36 g碳不完全燃烧所得气体中,CO占![]() 体积,CO2占
体积,CO2占![]() 体积。且有:
体积。且有:
C(s)+![]() O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
O2(g)===CO(g) ΔH=-110.5 kJ·mol-1
CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
与这些碳完全燃烧相比,损失的热量是
A. 172.5 kJ B. 1 149 kJ C. 283 kJ D. 517.5 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】六氟化硫分子呈正八面体(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起强温室效应,下列有关六氟化硫的推测正确的是( )
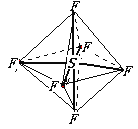
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.S—F键是 σ键,且键长、键能都相等
D.六氟化硫分子中只含极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L的NaOH标准溶液滴定20.00 mL0.1000 mol/L的HCl溶液,滴定曲线如图,下列有关说法正确的是( )

A.指示剂变色时,说明反应的酸、碱恰好等物质的量反应
B.当达到滴定终点时才存在c(Na+)+c(H+)=c(Cl-)+c(OH-)
C.达到滴定终点时,用甲基橙作指示剂消耗NaOH溶液体积比用酚酞多
D.已知H+(aq)+OH-(aq)=H2O(l)△H=-57.3 kJ/mol,上述滴定恰好中和时,放出114.6J的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4·xH2O是一种绿色易溶于水的晶体,广泛用于镀镍、电池等,可由电镀废渣(除镍外,还含有铜、锌、铁等元素)为原料获得.操作步骤如图:
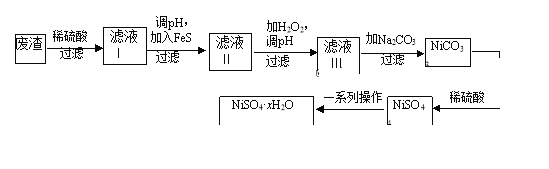
(1)在待镀件上镀镍时,待镀件应作____极,电镀过程中电解质溶液浓度___ (填“增大”、“减小”、“不变”)
(2)向滤液Ⅰ中加入FeS是为了除去Cu2+、Zn2+等杂质,则除去Cu2+的离子方程式为_____________.当Zn2+恰好沉淀完全时,在CuS、ZnS共存的混合液中c(Zn2+)=10﹣5mol/L,则c(Cu2+)=______mol/L(已知Ksp(CuS)=1.3×10﹣36,Ksp(ZnS)=1.6×10﹣24).
(3)对滤液Ⅱ中先加H2O2再调pH,调pH的目的是______________________________________________________________________.
(4)为测定NiSO4·xH2O晶体x的值,称取26.3g晶体加热至充全失去结晶水,剩余固体15.5g,则x的值等于__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废催化剂含![]() 、ZnS、CuS及少量的
、ZnS、CuS及少量的![]() 。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
。某实验小组以废催化剂为原料,回收锌和铜。设计实验流程如下:已知:CuS既不溶于稀硫酸,也不与稀硫酸反应。下列说法正确的是
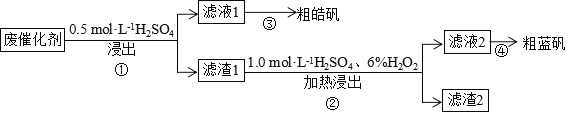
A.滤液1中是否含有![]() ,可以选用KSCN和新制的氯水检验
,可以选用KSCN和新制的氯水检验
B.步骤![]() 操作中,先加
操作中,先加![]()
![]() ,在不断搅拌下,再加入
,在不断搅拌下,再加入![]()
![]()
C.滤渣1成分是![]() 和CuS,滤渣2成分一定是
和CuS,滤渣2成分一定是![]()
D.步骤![]() 操作中,生成的气体需用NaOH溶液或
操作中,生成的气体需用NaOH溶液或![]() 溶液吸收
溶液吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:![]()
![]() 。相关条件和数据见下表:
。相关条件和数据见下表:
实验编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 5 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是( )
A. 实验Ⅲ达平衡后,恒温下再向容器中通入1molA和1molD,平衡不移动
B. 升高温度能加快反应速率的原理是降低了活化能,使活化分子百分数提高
C. 实验Ⅲ达平衡后容器内的压强是实验Ⅰ的0.9倍
D. K3>K2>K1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com