
| ||
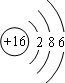 ,故答案为:
,故答案为: ;
;
| ||
| △ |
| ||
| △ |


科目:高中化学 来源: 题型:
| A、室温下NH3?H2O分子可能存在于pH=6的酸性溶液中 |
| B、在0.1mol?L-1氢氧化钠中加入适量的蒸馏水,溶液的c(H+)增大 |
| C、由水电离出的c(H+)=1×10-12mol?L-1的溶液中,AlO2-不可能大量存在 |
| D、在c(H+)=c(OH-)的溶液中,CO32-不可能大量存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg、Cu、Na、Al |
| B、Al、Cu、Na、Mg |
| C、Cu、Na、Al、Mg |
| D、Cu、Mg、Na、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
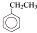
| CO4AlCl3.HCl |
| △ |
| M |
| OH- |
| -H2O |
| △ |
| C |
| (C11H12O) |
| ①Cu(OH)2 |
| ①酸化 |
| CH3OH |
| 浓H2SO4/△ |
| 催化剂 |
| F |
| (高聚物) |
 +CO
+CO| Al3.HCl |
| △ |
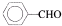
| OH- |
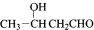
| -H2O |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 实验目的 | 玻璃仪器 |
| A | 验证Na2CO3和NaHCO3的热稳定性 | 酒精灯、试管、导气管 |
| B | 实验室用浓氨水和生石灰制备氨气 | 普通漏斗、烧杯、玻璃棒 |
| C | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 |
| D | 分离乙醇和乙酸乙酯的混合物 | 分液漏斗、烧杯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丙炔分子中有6个σ键,2个π键 |
| B、丙炔分子中3个碳原子都是sp杂化 |
| C、丙炔分子中只存在极性键 |
| D、丙炔分子中的π键比σ键稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子半径:Ca2+>Cl->S2- |
| B、非金属性:Si>C>N |
| C、电负性:F>S>Mg |
| D、热稳定性:CH4>H2S>NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
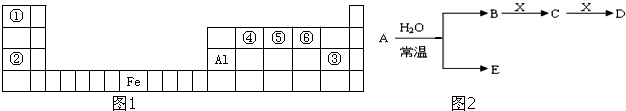
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com