
����Ŀ����ˮ�Ȼ������壨BaCl22H2O���ڹ�ҵ����Ҫ����������ֱ��Ρ����Ϻ��л�Ⱦ�ϣ�ij�о�С�����ؾ�ʯ����Ҫ�ɷ� BaSO4���Ʊ�BaCl22H2O ��������ͼ��
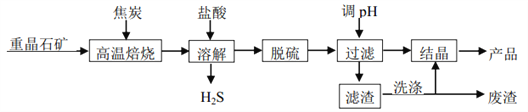
��1����֪��
�� BaSO4(s)+ 4C(s)= 4CO(g) + BaS(s) ��H1 = 571.2kJmol��1
�� C(s)+ CO2(g)= 2CO(g) ��H2 = 172.5 kJmol��1
��Ӧ BaSO4(s)+ 2C(s)= 2CO2(g)+ BaS(s)����H = _____ kJmol��1
��2�����±�������������̿��ͬʱ��Ҫͨ���������Ŀ����_____��_____��
��3����������з�Ϊ������ ��һ������������ �ڶ����ǻ�ѧ����
�� ����������ֱ�����������£����ÿ���������������ȥ��������_____��
�� �������ʲ����������������_____ (����ĸ)��
A. ������� B. �������� C. ˫��ˮ D.����
��4������������ϴ����������ҪĿ����_____��
��5���ܽ�ʱ������ H2S ���� 80~85 ��ʱ��ʯ�ҵ��Ͻ�(CaCN2�Ľ�ˮ�����)���ղ��Ƶø��м�ֵ�IJ�Ʒ��������[CS(NH2)2]����ʯ�ҡ���д���Ʊ�����Ļ�ѧ����ʽ_____��
���𰸡� 226.2 ʹ BaSO4�õ���ֵĻ�ԭ������� BaS�IJ����� �٢�Ϊ���ȷ�Ӧ��̿��������Ӧ����ά�ַ�Ӧ������� H2S AB ���ٷ����п����Ա��ζԻ�������Ⱦ���������𰸾��ɣ� H2S + CaCN2+ 2H2O = CS(NH2)2+Ca(OH)2
����������1���ɸ�˹���������H=��H1��2����H2= 226.2��
��2�����±�������������̿��ͬʱ��Ҫͨ���������Ŀ����ʹ BaSO4�õ���ֵĻ�ԭ���൱�ڽ������ã�������� BaS�IJ�������ͬʱ��Ӧ�٢�Ϊ���ȷ�Ӧ��̿��������Ӧ����ά�ַ�Ӧ������£���3��������������ֱ�����������£�������������Һ�е��ܽ�ȣ��ÿ���������������H2S�������Һ�С�����������ȥ�������������ܽ����Һ�д��ڴ��������ӣ��ø�����ء����������������ʱ��H2S�������Ӿ���֮��Ӧ��������ء��������Ƶ���������ͬʱ�����ܻ������Ⱦ���������壬�ʲ���AB����4�����������ؽ������ӣ��Ի�����Ӱ�죬ϴ����������ҪĿ���Ǽ��ٷ����п����Ա��ζԻ�������Ⱦ����5��������������Ӧ��������д���Ʊ�����Ļ�ѧ����ʽ��H2S + CaCN2+ 2H2O = CS(NH2)2+Ca(OH)2��


 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д� �ۺ��Բ�ϵ�д�
�ۺ��Բ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� Al��CuO��Fe2O3 ��ɵĻ���ﹲ 10.0g������ 500mL ijŨ��������Һ�У��������ȫ�ܽ⣬���� ���� 250mL 2.0mol/L �� NaOH ��Һʱ���õ��ij�����ࡣ�������Ũ��Ϊ�� ��
A. 0.5 mol/L B. 3.0 mol/L C. 1.0 mol/L D. 2.0 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ��̽����������Է�ӦX(g)+Y(?)![]() cZ(g)��Ӱ�죬��X��Y���ʵ���֮��Ϊ1��1��ʼ��Ӧ��ͨ��ʵ��õ���ͬ������ƽ��ʱZ�����������ʵ������ͼ��ʾ�������ж���ȷ����
cZ(g)��Ӱ�죬��X��Y���ʵ���֮��Ϊ1��1��ʼ��Ӧ��ͨ��ʵ��õ���ͬ������ƽ��ʱZ�����������ʵ������ͼ��ʾ�������ж���ȷ����
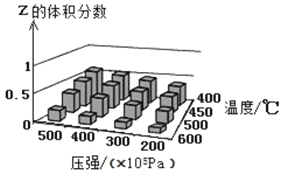
A. ��H>0 c<2
B. 400����4��l07Pa�£��÷�Ӧ��ƽ��ʱX�����������25%
C. Y����������Ҳ�����Ƿ�����
D. ��Ӧ���ת������ѹǿ�������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͭ������í�����ڱ�¶�ڳ�ʪ�Ŀ����У��γ�һ������ˮĤ����í���ᱻ��ʴ��ʾ��ͼ���¡�����˵������ȷ����

A. ��ʴ������ͭ����ʼ��ֻ������ 2H++2e-= H2��
B. ��ˮĤ������ʳ�ν��ӿ���í���ĸ�ʴ
C. ���ڽ�������Ϳһ����֬�ܷ�ֹ��í������ʴ
D. ������ͭ����ֱ����������������ͭ���ѱ���ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֽ�Ũ����ȡ�����ֱ�ΪV1��V2��H2SO4��NaOH��Һ��ϣ��������Һ�¶ȣ������ͼ����֪��V1+V2=60mL������������������� ( )

A. ʵ��Ļ����¶ȵ���22�� B. �����Һ�ĵ���������M>N
C. P������Һ������ D. ����H2SO4��ΪCH3COOH��P���¶ȵ���28��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֤���Ҵ���������һ���ǻ�����ʵ���� ��
A. �Ҵ���ȫȼ������CO2��H2O B. 0.1 mol�Ҵ��������Ʒ�Ӧ����0.05 mol����
C. �Ҵ�������ˮ D. �Ҵ�����ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ�������Ӧ�þ���ȷ���ǣ� ��
A.SO2��Cl2����ʹƷ����Һ��ɫ�����ߵ������Ͽ�����ǿƯ������
B.Na2O2�Ǽ������������ǿ�����Կ�����ɱ������
C.������һ�ּ������壬���ü�ʯ�һ���ˮCaCl2����
D.MgO���۵�ܸߣ��������������²���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Է�������Ϊ 43 �����ȡ���ױ��ϵ�һ����ԭ�ӣ����÷������������ĿΪ�� ��
A.3 ��B.4 ��C.6 ��D.8 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1.52g ͭþ�Ͻ���ȫ�ܽ���50mL �ܶ�Ϊ1.40 g/mL����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������1120 mL����״��������Ӧ�����Һ�м���1.0 mol/L NaOH��Һ������������ȫ������ʱ���õ�2.54 g����������˵������ȷ���ǣ�������
A. �úϽ���ͭ��þ�����ʵ���֮����2:1
B. ��Ũ������HNO3�����ʵ���Ũ����14.0 mol/L
C. NO2��N2O4�Ļ�������У�NO2�����������80%
D. �õ�2.54 g����ʱ������NaOH��Һ�������600 mL
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com