
��14�֣�ʪ����п��ұ�����̿�����ͼ���Ա�ʾ��
��ش��������⣺
��1����֪:N2(g)��2H2(g)===N2H4(l) ��H��a kJ��mol��1���÷�Ӧ�����Է����У���a 0(�����������������).
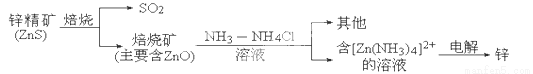
��2��ZnS���յķ�Ӧ2ZnS��3O2 2SO2��2ZnO���漰�������У�����������Ӧ�������� ���������Ӽ��Ļ������� .
2SO2��2ZnO���漰�������У�����������Ӧ�������� ���������Ӽ��Ļ������� .
��3��������������п�ĵ缫��ӦʽΪ___________________________.
��4��������SO2����Ba(NO3)2��Һ���գ����ֲ������Ϊ��ҵԭ�ϣ��䷴Ӧ�����ӷ���ʽΪ .
��5��п-���������﮵����ȣ����д�������ߡ��ɱ��͡�û�а�ȫ�������ŵ㡣�õ�ص��ܷ�ӦΪ2Zn��O2===2ZnO���������ҺΪKOH��Һ�����ĵ缫��ӦʽΪ ��25��ʱ���Ըõ��Ϊ��Դ����������������ͭ�����缫���500 mL 0.1mol/L CuSO4��Һ��һ��ʱ����жϵ�Դ���Ե缫���ﲢ������������缫��������Ϊ9.6 g����������Ҫ________L����(����ɱ�״��)����õ�ء�
��1��������2��ZnS��SO2����3��Zn[��NH3��4]2++2e-=Zn+4NH3����
��4��3SO2+3Ba2++2H2O+2NO3-=3BaSO4��+2NO��+4H+����5��Zn-2e-+2OH-=ZnO+H2O�� 4.2L��
��������
�����������1�����ݻ�ѧ��Ӧ������оݦ�H��T��S���������ȵ��ؼ��ٵķ�Ӧ���κ������¶������Է����У��÷�Ӧ��һ���ؼ�С�ķ�Ӧ�����Ե��÷�ӦΪ���ȷ�Ӧ��a��0ʱ���÷�Ӧ���κ������¶������Է����У���2����������ԭ��Ӧ�У�ZnS����Ԫ�صĻ��ϼ��ɡ�2�����ߵ�0�ۣ�����������Ӧ�����ý����ͷǽ���Ԫ��֮���γɵĻ�ѧ�������Ӽ�����ZnS��ZnO��SO2���ڹ��ۻ����ֻ���й��ۼ�����3�������У�������Zn[��NH3��4]2+�������Ϸ����õ��ӵĻ�ԭ��Ӧ����ⷴӦʽΪ��Zn[��NH3��4]2++2e-=Zn+4NH3������4��������������������Ժ����ᱵ��Һ֮�䷢��������ԭ��Ӧ���õ���ɫ�������ᱵ��NO���壬���ӷ���ʽΪ3SO2+3Ba2++2H2O+2NO3-=3BaSO4��+2NO��+4H+����5����п-�������ԭ��صĸ������ǽ���п����ʧ���ӵ�������Ӧ���ڼ��Ի����£��缫��ӦʽΪ��Zn-2e-+2OH-=ZnO+H2O���Ըõ��Ϊ��Դ����������������ͭ�����缫���500mL 0.1mol/L CuSO4��Һ����������Cu-2e-=Cu2+����������Cu2++2e-=Cu���Ե缫���ﲢ������������缫��������Ϊ9.6g������ٵ�ͭ�����ɵ�ͭ����4.8g��0.075mol��ת�Ƶ�����0.15mol�����ݷ�Ӧ2Zn+O2�T2ZnO����ת�Ƶ�����4molʱ������������1moL������ת�Ƶ�����0.15molʱ������������0.0375moL����������ǿ����ἰ�����֮һ���������Ŀ����������0.0375moL��5��22.4L/mol=4.2L��
���㣺���黯ѧ��Ӧ������жϣ�������ԭ��Ӧ�����ӻ�������ۻ�����ĸ���绯ѧԭ����Ӧ�ã����ӷ���ʽ�͵缫��Ӧʽ����д��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2013-2014����ʡ��ƽ�ظ߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
���������У�һ�ȴ���ֻ��һ�ֵ��� �� ��
A������ B������ C��2-������ D��2,2-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014��������ѧ�����п��Ը�һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
��ѧ��ѧ�кܶࡰ���ɡ����������ƣ����и����йء����ɡ��Ƴ��Ľ�����ȷ����(����)
A��CO2Ϊֱ���η��ӣ���CS2ҲΪֱ���η���
B��Ũ������Ը���HCl���壬��Ҳ����Ũ�������HI����
C��Na�ڿ�����ȼ�ջ�����Na2O2����Li�ڿ�����ȼ��Ҳ������Li2O2
D��±��Ԫ�ص�����˵���������۵����ߣ��ʼ���������۵�Ҳ��˵�������Ӷ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014������5�¸����¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
��17�֣����տ�ѧ�����з����л��ϳ��е��ٴ��Ľ���ż���������2010���ŵ������ѧ�����л��ϳɳ��õ���/����̿��������ʹ�ã������ᱻ���ʣ��磺�����л���ȣ���Ⱦ��ʧȥ���ԣ���Ϊ�ϴ��������������������á�һ���ɷϴ�����ȡ�Ȼ���(PdCl2)�Ĺ����������£�
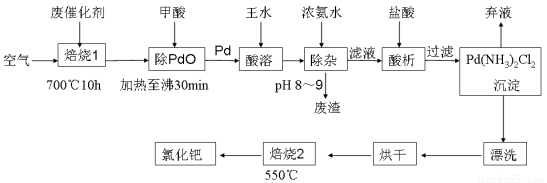
��1�����ỹԭ�����ٵĻ�ѧ����ʽΪ�������� ������������ ��
��2����Ũ��ˮʱ����Ԫ��ת��Ϊ������[Pd(NH3)4]2+����ʱ��Ԫ�صĴ�����ʽ�ǡ���������д��ѧʽ����
��3����ˮ��Ũ������Ũ���ᰴ�����1��3��϶��ɵģ�������ˮ���ܽ�Ĺ������л�����A��һ����ɫ���ж�����B���ɡ�
��������B�Ļ�ѧʽΪ��������
���ھ��ⶨ��������A��3��Ԫ����ɣ��й�Ԫ�ص���������ΪPd��42.4%��H��0.8%����A�Ļ�ѧʽΪ����
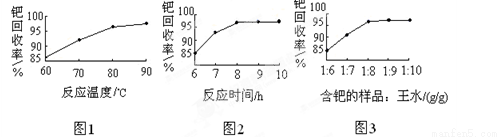
��4���ٵĻ����ʸߵ���Ҫȡ������ˮ�ܽ�IJ�����������֪��Ӧ�¶ȡ���Ӧʱ�����ˮ�������ٻ����ʵ�Ӱ����ͼ1��ͼ3��ʾ������ˮ�ܽ��ٵ����������ǣ���Ӧ�¶�Ϊ�� ����Ӧʱ��ԼΪ�� �����ٵ���Ʒ����ˮ��������Ϊ���� ������ ��
��5��700�桰����1����Ŀ���ǡ������� �� 550�桰����2����Ŀ���ǡ������������������������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014������5�¸����¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
����ʵ�������Ԥ�ڵ�ʵ��Ŀ�Ļ���۾���ȷ����
ѡ�� | ʵ����� | Ԥ�ڵ�ʵ��Ŀ�Ļ���� |
A | ��ij��ɫ���������ɫ��Ӧʵ�飬����ʻ�ɫ | ������Ϊ���� |
B | SO2ͨ��ij��ɫ��Һ�У���Һ��ɫ | ����ҺΪƷ����Һ |
C | ������Һ�м�������ϡ������ȣ�Ȼ���������Һ�ټ��� | ��֤������ǿ�����������Ƿ���ˮ�� |
D | pH��Ϊ1�����ᡢ������Һ�ֱ�������ˮϡ��m����n�����pH��ͬ | m��n |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014��������У���˸����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
һ�������£�������Ӧ����M(s)+N(g)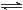 R(g) ��H = ��Q1 kJ��mol��1����2R (g)+N(g)
R(g) ��H = ��Q1 kJ��mol��1����2R (g)+N(g)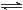 2T (g) ��H = ��Q2 kJ��mol��1�� Q1��Q2 ��Q3��Ϊ��ֵ������˵����ȷ����
2T (g) ��H = ��Q2 kJ��mol��1�� Q1��Q2 ��Q3��Ϊ��ֵ������˵����ȷ����
A��1 mol R(g)�������ܺʹ���1 mol M(s)��1 mol N(g) �������ܺ�
B����2 mol R (g)��1 mol N(g)�ڸ������³�ַ�Ӧ,�ų�����Q2 kJ
C����1 mol M(s)��ȫת��ΪT (g)ʱ(�ٶ���������ʧ)���ų�����Q1+ kJ
kJ
D��M(g)+N(g)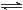 R(g) ��H=��Q3 kJ��mol��1 , ��Q3 ��Q1
R(g) ��H=��Q3 kJ��mol��1 , ��Q3 ��Q1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014�����и���5���¿����ۻ�ѧ�Ծ��������棩 ���ͣ�ʵ����
(12��)Ϊ��֤�����ԣ�Cl2>Fe3+>SO2��ijС������ͼ��ʾװ�ý���ʵ��(�г�������A�еļ���װ�����ԣ��������Ѿ��������)ʵ��������£�
���ɼ�K1��K4��ͨ��һ��ʱ��N2���ٽ�T�͵��ܲ���B�У�����ͨ��N2��Ȼ��ر�K1��K3��K4��
����a���μ�һ������Ũ���ᣬ��A���ȣ�
��B�е���Һ���ʱ��ֹͣ���ȣ��н����ɼ�K2��
��������b��ʹԼ2ml����Һ����D�Թ��У��������е����ӣ�
V�����ɼ�K3������c������70�������ᣬһ��ʱ���н����ɼ�K3��
���������Թ�D���ظ����̢�������B��Һ�е����ӣ�
��1�����̢��Ŀ����______________________��
��2�����н������ҺΪ__________________��
��3��A�з�����Ӧ�Ļ�ѧ����ʽΪ__________________________________��
��4����70����������ȡSO2����Ӧ���ʱ���98��������죬ԭ����______________
��5�����̢��м���B��Һ���Ƿ���������IJ�����________________________________
��6���ס��ҡ�����λͬѧ�ֱ����������ʵ�飬���ǵļ����һ���ܹ�֤��������Cl2>Fe3+>SO2����
| ����IV B��Һ�к��е����� | ����VI B��Һ�к��е����� |
�� | ��Fe3+��Fe2+ | ��SO42�� |
�� | ����Fe3+����Fe2+ | ��SO42�� |
�� | ��Fe3+��Fe2+ | ��Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014��������У����5�µ���������Կ������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
4�ֶ�����Ԫ��W��X��Y��Z��ԭ����������������ԭ�ӵ�����������֮��Ϊ19��W��XԪ��ԭ����������֮��Ϊ1��2��X2+��Z�����ӵĵ�����֮��Ϊ8������˵������ȷ����
A����W���ڵ�ͬ����Ԫ�ؿ��Ƴ���Ҫ�İ뵼�����
B��Ԫ��ԭ�Ӱ뾶�Ӵ�С��˳����X��Y��Z
C��WZ4������W��Zԭ��ͨ�����ۼ�������������ﵽ8���ӽṹ
D��W��Y��ZԪ�ض�Ӧ���⻯���ȶ�����ǿ����H2Y
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014����һ�и߶���ѧ����ĩ���Ի�ѧ�Ծ��������棩 ���ͣ�ѡ����
����˵������ȷ����
A��(NH4)2SO4��CuSO4��Һ����ʹ�����ʳ�������
B���������ȩ���������������ɷ�ȩ��֬�Ľṹ��ʽΪ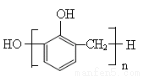
C�������Ӳ֬�ụΪͬϵ�C6H14��C9H20Ҳһ����Ϊͬϵ��
D��Ҷ��ĽṹΪ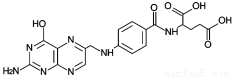 �������Է���������ˮ�⡢�ӳɵȷ�Ӧ
�������Է���������ˮ�⡢�ӳɵȷ�Ӧ
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com