
| A. | 胆矾 玻璃 | B. | 汽油 液氯 | C. | 石油 盐酸 | D. | 干冰 铝热剂 |
分析 纯净物是由一种物质组成的物质,混合物是由多种物质组成的物质,据此结合常见物质的组成成分逐项分析即可.
解答 解:A.胆矾是五水合硫酸铜,由一种物质组成的,属于纯净物,玻璃中含有硅酸钠、硅酸钙和二氧化碳,属于混合物,故A不选;
B.汽油是由多种烃组成的混合物,液氯是液态氯气,是单质,属于纯净物,故B选;
C.石油是有烷烃、环烷烃和芳香烃组成的混合物,盐酸是氯化氢的水溶液,属于混合物,故C不选;
D.干冰是固体二氧化碳,由一种物质组成的,属于纯净物,铝热剂是由金属氧化物和铝粉组成的混合物,故D不选.
故选B.
点评 本题主要考查物质的分类,解答本题要充分理解纯净物和混合物的区别,要分析物质是由几种物质组成的,如果只有一种物质组成就属于纯净物,如果有多种物质就属于混合物,题目难度不大.


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
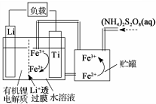
| A. | Li+透过膜除允许Li+通过外,还允许H2O分子通过 | |
| B. | 放电时,进入贮罐的液体发生:S2O82-+2Fe2+=2Fe3++2SO42- | |
| C. | 充电时,钛电极与外电源的负极相连 | |
| D. | 充电时,电池内部发生的总反应为Li++Fe3+=Li+Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑥⑦ | B. | ③⑦ | C. | ③⑤⑥ | D. | ③⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应常温下能自发进行,高温和催化剂只是加快反应的速率 | |
| B. | 该反应中反应物的总能量低于生成物的总能量 | |
| C. | 反应达到平衡后,NO的反应速率保持恒定 | |
| D. | 单位时间内消耗CO和CO2的物质的量相等时,反应达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤⑥⑦ | B. | ③⑤ | C. | ①②④⑦ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5ml | B. | 15ml | C. | 20ml | D. | 25ml |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
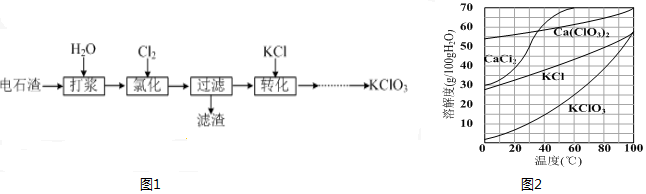
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表有7个主族,7个副族,1个0族,1个Ⅷ族,共16个纵行 | |
| B. | 元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素 | |
| C. | 除氦外的稀有气体原子的最外层电子数都是8 | |
| D. | 同一元素的各种同位素的化学性质相似 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com