
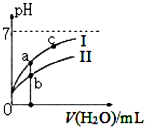
 己知:下表为25℃时某些弱酸的电离平衡常数.
己知:下表为25℃时某些弱酸的电离平衡常数.| CH3COOH | HClO | H2CO3 |
| Ka=1.8×10-5 | Ka=3.0×10-8 | Ka1=4.4×10-7Ka2=4.7×10-11 |
| A. | 图中c(H+):c(R-)的值:a点>c点(HR代表CH3COOH或HCIO) | |
| B. | pH相同的四种溶液浓度关系:c(CH3COONa>c(NaHC03>c(NaClO>c(Na2C03) | |
| C. | 图中a点酸的总浓度小于b点酸的总浓度 | |
| D. | 浓度均为0.l mol/L的CH3COONa和NaCIO的混合溶液中:c(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH) |
分析 A.加水稀释,氢离子浓度和酸根离子浓度均减小,但是酸根离子减小的程度大;
B.电离常数越大,酸性越强,其盐溶液的水解程度越小;
C.稀释前,CH3COOH、HCl0的pH相同,由于HClO的酸性弱,所以HClO的浓度大;
D.根据电荷守恒和物料守恒分析.
解答 解:A.加水稀释,氢离子浓度和酸根离子浓度均减小,由于水也能电离出氢离子,所以酸根离子减小的程度大,即浓度越小,c(H+):c(R-)的值越大,所以图中c(H+):c(R-)的值:a点<c点,故A错误;
B.电离常数越大,酸性越强,其盐溶液的水解程度越小,溶液的碱性越弱,即pH越小,所以pH相同时,酸性强的对应盐的浓度大,所以pH相同的四种溶液浓度关系:c(CH3COONa>c(NaHC03>c(NaClO>c(Na2C03),故B正确;
C.稀释前,CH3COOH、HCl0的pH相同,由于HClO的酸性弱,所以HClO的浓度大,所以HClO的总浓度大于CH3COOH,则稀释相同的倍数,HClO的总浓度大于CH3COOH,即图中a点酸的总浓度小于b点酸的总浓度,故C正确;
D.浓度均为0.l mol/L的CH3COONa和NaCIO的混合溶液中,电荷守恒为c(ClO-)+c(OH-)+c(CH3COO-)=c(H+)+c(Na+),物料守恒为c(CH3COOH)+c(CH3COO-)=0.1mol/L,c(HClO)+c(ClO-)=0.1mol/L,所以c(OH-)=0.l mol/L-c(ClO-)+c(H+)+c(CH3COOH),故D正确.
故选A.
点评 本题考查电解质的强弱与电离常数的关系,题目难度中等,试题侧重于学生的分析能力和计算能力的考查,明确酸的电离常数与酸的强弱、酸根离子水解能力的关系是解本题关键.


科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | ④ | |
| pH | 12 | 12 | 2 | 2 |
| 溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
| A. | 在①、②两溶液中分别加入氯化铵晶体,两溶液的pH均增大 | |
| B. | 将等体积的①和②两溶液分别加水稀释100倍,所得溶液的pH:①>② | |
| C. | 把①、④两溶液等体积混合后所得溶液中:[Cl-]>[NH4+]>[OH-]>[H+] | |
| D. | 将溶液②和溶液③等体积混合,混合后所得溶液的pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:
某学生用0.1000 mol•L-1KOH液滴定未知浓度的醋酸,其操作分解为如下几步:| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
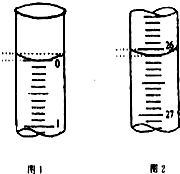 某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来测定未知物质的量浓度的氢氧化钠溶液时,选择甲基橙作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠溶液的体积/mL | 0.1000mol•L-1盐酸的体积/mL | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体积/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
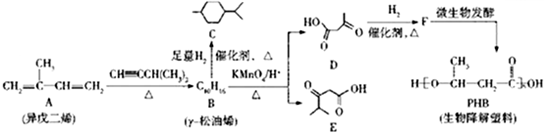
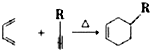
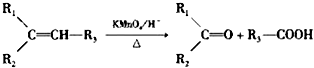
 .反应类型为加成反应或还原反应.
.反应类型为加成反应或还原反应.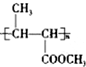 的合成路线
的合成路线 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com