
【题目】将3.2 gCu投入到一定浓度的HNO3溶液中,恰好完全反应,产生NO2和NO的混合气体共 0.08 mol。则原溶液中HNO3的物质的量为( )
A.0.34 molB.0.38 molC.0.28 molD.0.18 mol
 发散思维新课堂系列答案
发散思维新课堂系列答案科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O35H2O)俗名“大苏打”,又称“海波”.已知Na2S2O35H2O是无色透明晶体,易溶于水,不溶于乙醇.它受热、遇酸易分解,在空气中易被氧化.某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O35H2O).反应原理为2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2 . 
(1)(图1)制备Na2S2O3
①仪器b的名称 , d中盛放的试剂是 .
②b中制备SO2 , 反应的化学方程式 .
③反应开始后,要控制SO2生成速率,可以采取的措施有(写出一条即可).
(2)分离Na2S2O3并测定含量(图2)
(I)为了减少产品损失,操作①时需 . 操作②是过滤、洗涤、干燥,其中洗涤操作时用做洗涤剂.干燥操作时(装置如图3所示),通入H2的目的是 .
(II)制得的粗晶体中往往含有少量杂质.为了测定粗产品中Na2S2O35H2O的含量,采用在酸性条件下用KMnO4标准液滴定的方法(假设粗产品中的杂质与酸性KMnO4溶液不反应).称取1.50g粗产品溶于水,用0.20molL﹣1KMnO4溶液(加适量稀硫酸酸化)滴定,当溶液中S2O32﹣全部被氧化时,消耗高锰酸钾溶液体积40.00mL.(5S2O32﹣+8MnO4﹣+14H+═8Mn2++10SO42﹣+7H2O)
①KMnO4溶液置于(填“酸式”或“碱式”)滴定管中.
②若 , 则达到滴定终点.
③产品中Na2S2O35H2O的质量分数为(保留小数点后一位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据题意解答
(1)工业上制取硝酸的主要流程图如图1: 
(I)工业合成氨的原料是N2和H2 . 装置A的名称是;其中N2可从空气中分离出来,方法是先将空气 , 然后即可得到;H2可以水和天然气为原料在催化剂作用下高温制取,其化学方程式为 .
(II)在原料气制备过程中混有的CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应:CO(g)+H2O(g)═CO2(g)+H2(g)来实现.已知1100K时该反应的平衡常数K=0.64,若要使CO的转化率超过80%,则起始物中c(H2O):c(CO)不低于 .
(2)利用石灰乳来除去硝酸工业的尾气(含NO、NO2),既能净化尾气,又能获得应用广泛的Ca(NO2)2 , 其部分工艺流程如图2.已知NO和NO2按1:1通入碱液中生成亚硝酸盐. 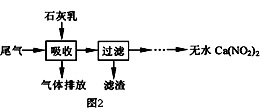
(I)上述工艺中采用气﹣液逆流接触吸收(尾气从吸收塔底进入,石灰乳从吸收塔顶喷淋),其目的是;滤渣可循环使用,滤渣的主要成分是(填化学式).
(II)该工艺需控制NO 和NO2 物质的量之比接近1:1.若n(NO):n(NO2)>1:1,则会导致;若n(NO):n(NO2)<1:1,则会导致 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取氯气的装置如图: 
(1)实验室制取氯气的化学方程式为:MnO2+4HCl(浓)=MnCl2++2H2O;氧化剂
(2)实验室通常用饱和食盐水吸收杂质 , B瓶盛装的试剂是
(3)C装置吸收氯气用 , 反应的化学方程式为
(4)检验氯气是否泄漏用湿的试纸,若泄漏试纸变色.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用高岭土(主要成分为A12 O3、SiO2和Fe2O3)为原料制备水质净化剂PAC{[A12(OH)nC16﹣n]m(n<6,m为聚合度)}的过程如图.下列说法正确的是( ) 
A.试剂X为H2SO4
B.滤渣主要成分为Fe(OH)3、H2 SiO3
C.调pH过高或过低均会减少PAC生成
D.滤液浓缩聚合过程发生了加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】哈佛大学A.Y.Liu教授首次合成类金刚石相氮化碳(β﹣﹣C3N4).福州大学王新晨教授在此基础上以单氰胺(CH2N2)为原料制得光催化剂类石墨相氮化碳(g﹣C3N4),其单层结构如图a, 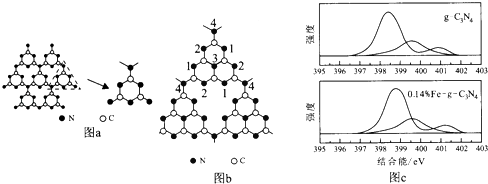
(1)C,H,N元素电负性从大到小的顺序为(填元素符号).
(2)β﹣﹣C3N4熔点、硬度均高于金刚石,其原因为 .
(3)β﹣﹣C3N4和g﹣﹣C3N4中碳原子的杂化轨道类型分别为 .
(4)单氰胺的结构式为 .
(5)g﹣﹣C3N4中存在的作用力为(填序号).
a.离子键 b.σ键 c.π键 d.氢键 e.范德华力
(6)g﹣﹣C3N4中掺杂少量铁元素能提高光催化效果.图b为g﹣﹣C3N4的另一种单层结构;图c为Fe3+掺杂前后N﹣1s谱图(N原子1s的XPS谱图,图中峰的强度正比于原子数目),图c中横坐标为g﹣﹣C3N4中N﹣1s结合能(原子结合能与稳定性成正比),掺杂Fe3+后,结合能最小的谱线发生了明显右移.
①Fe3+的价电子轨道表示式为 .
②发生位移的谱线对应的N原子为(填图b中的序号).
③谱线右移的原因为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有Al2(SO4)3、Al2O3和Fe2O3 , 在一定条件下可实现如图所示变化. 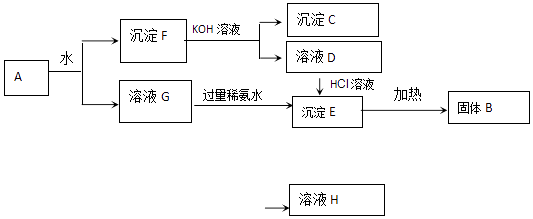
请回答下列问题.
(1)、C、D、G、H 4种物质的化学式为:C、D、G、H .
(2)沉淀F与KOH溶液反应的离子方程式为沉淀E加热生成B的化学方程式为溶液G与过量稀氨水反应的化学方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com