
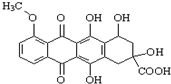
 ,有关该物质的说法不正确的是( )
,有关该物质的说法不正确的是( )| A. | 该化合物属于芳香族化合物,分子式为C20H16O9 | |
| B. | 能发生消去反应、酯化反应、取代反应、氧化反应、水解反应等 | |
| C. | 能分别与金属Na、NaHCO3溶液反应 | |
| D. | 1 mol该有机物与足量NaOH溶液反应,消耗3 mol NaOH |
分析 该物质中含有酚羟基、羰基、醚键、苯环、醇羟基和羧基,具有酚、酮、醚、苯、醇、羧酸的性质,能发生氧化反应、加成反应、还原反应、取代反应、酯化反应、消去反应等,据此分析解答.
解答 解:A.该化合物中含有苯环,所以属于芳香族化合物,根据结构简式知,其分子式为C20H16O9,故A正确;
B.因为不含酯基或卤原子,所以不能发生水解反应,故B错误;
C.含有酚羟基、醇羟基和羧基,所以能和钠反应生成氢气,因为含有羧基,所以能和碳酸氢钠反应生成二氧化碳,故C正确;
D.该物质中羧基、酚羟基能和氢氧化钠反应,所以1 mol该有机物与足量NaOH溶液反应,消耗3 mol NaOH,故D正确;
故选B.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酚、醇、羧酸的性质,易错选项是D.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 1 | C. | 0 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:3 | B. | 3:1 | C. | 1:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 “酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如图所示的装置制取乙酸乙酯.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA |
| 二 | ① | ② | ③ | ||||
| 三 | ⑦ | ④ | ⑤ | ⑥ | |||
| 四 | ⑧ | ⑨ | ⑩ |
 ,
,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
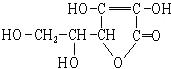
| A. | 分子式为C6H8O6 | B. | 易起氧化及加成反应 | ||
| C. | 可以溶于水 | D. | 在碱性溶液中能稳定地存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | .①②③④ | B. | .①②③ | C. | ②③④ | D. | .① |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com