
某校文印室里有两台复印机长期工作着,使用和操作复印机的师傅,时常感到身体有不适的现象.一天,一位学生知道后,查阅了相关资料,了解到复印机工作时易产生臭氧,臭氧浓度过高时,对人体有害.臭氧具有强氧化性,可以使湿润的碘化钾淀粉试纸变蓝,其中臭氧部分转化为氧气.
(1)写出并配平发生反应的离子方程式 ;
(2)该反应的氧化剂是 ,还原产物是 ;
(3)反应中1mol臭氧 (填“得到”或“失去”)2mol电子.
考点: 氧化还原反应方程式的配平;氧化还原反应.
分析: (1)臭氧具有强氧化性,能和碘离子反应生成碘和氧气,臭氧中部分O元素化合价由0价变为﹣2价、碘元 素化合价由﹣1价变为0价,根据转移电子守恒结合原子守恒
素化合价由﹣1价变为0价,根据转移电子守恒结合原子守恒 配平方程式;
配平方程式;
(2)在氧化还原反应中得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物;
(3)该反应中部分臭氧得电子化合价降低.
解答: 解:(1)臭氧具有强氧化性,能和碘离子反应生成碘和氧气,臭氧中部分O元素化合价由0价变为﹣2价、碘元素化合价由﹣1价变为0价,同时溶液中还生成氢氧根离子,根据转移电子守恒结合原子守恒配平方程式为O3+2I﹣+H2O=2OH﹣+I2+O2,故答案为:O3+2I﹣+H2O=2OH﹣+I2+O2;
(2)在氧化还原反应中得电子化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,氧化剂对应的产物是还原产物,还原剂对应的产物是氧化产物,臭氧中部分O元素化合价由0价变为﹣2价、碘元素化合价由﹣1价变为0价,所以O3是氧化剂、还原产物是OH﹣,
故答案为:O3; OH﹣;
(3)反应中部分臭氧中O元素化合价在反应中由0价变为﹣2价,根据方程式知,参加反应的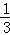 臭氧在反应中得电子,如果有1mol臭氧参加反应,得到电子的物质的量=1mol×
臭氧在反应中得电子,如果有1mol臭氧参加反应,得到电子的物质的量=1mol×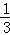 ×3×=2mol,
×3×=2mol,
故答案为:得到;2.
点评: 本题考查氧化还原反应的配平、计算及基本概念,明确元素化合价变化是解本题关键,注意该反应中臭氧只有一部分作氧化剂,题目难度不大.


科目:高中化学 来源: 题型:
现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol.若阿伏加德罗常数的值用NA表示,则:
(1)该气体的物质的量为 mol.
(2)该气体所含原子总数为 个.
(3)该气体在标准状况下的体积为 L.
(4)该气体溶于1L水中(不考虑反应),形成的溶液溶质的质量分数为 %.
(5)该气体溶于水形成VL溶液,其溶液的物质的量浓度为 mol/L.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的性质比较,正确的是()
A. 气态氢化物稳定性:HF>HCl>H2S
B. 碱性:NaOH>KOH>RbOH
C. 非金属性:P>S>Cl
D. 酸性:H2SO4>HClO4>HBrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
从矿物学资料查得,一定条件下自然界存在如下反应14CuSO4+5FeS2+12H2O=7Cu2S+5FeSO4+12H2SO4.下列说法正确的是()
A. Cu2S既是氧化产物又是还原产物
B. 5molFeS2发生反应,有10mol电子转移
C. 产物中的SO42﹣离子有一部分是氧化产物
D. FeS2只作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化还原反应:2Cu(IO3)2+24KI+12H2SO4=2CuI↓+13I2+12K2SO4+12H2O,其中1mol氧化剂在反应中得到的电子为()
A. 10mol B. 11mol C. 12mol D. 13mol
查看答案和解析>>
科目:高中化学 来源: 题型:
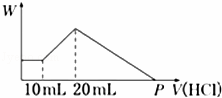
把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:
(1)混合物中NaOH的质量为 g,混合物中AlCl3的质量为 g,混合物中MgCl2的质量为 g.
(2)P点表示盐酸的体积是 mL.
查看答案和解析>>
科目:高中化学 来源: 题型:
为了除去KCl中的Ca2+,Mg2+,SO42﹣及泥沙,得到纯净的KCl,可将固体溶于水,然后在下列操作中选取必要的步骤和最佳的操作顺序( )
①过滤 ②加过量KOH溶液 ③加适量盐酸 ④加过量K2CO3溶液 ⑤加过量BaCl2溶液.
|
| A. | ②①⑤①④①③ | B. | ④①②⑤③ | C. | ②⑤④①③ | D. | ①④②⑤③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题:
(1)该浓盐酸中HCl的物质的量浓度为 mol•L﹣1.
(2)取用任意体积的该盐酸溶液时,下列物理量中,不随取用的体积多少而变化的是 .
A.HCl的摩尔质量 B.溶液的浓度
C.溶液中Cl﹣的质量分数 D.溶液的密度
(3)某学生用上述浓盐酸和蒸馏水配制480mL 物质的量浓度为0.4mol•L﹣1的稀盐酸.
①该学生需选择容量瓶的规格为 mL;(填:100、250、500、1000)
该学生需要量取 ml 上述浓盐酸进行配制.
②在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?
Ⅰ.用量筒量取浓盐酸时,俯视观察凹液面
Ⅱ.定容后经振荡、摇匀、静置,发现液面下降,再加适量的蒸馏水
(填:“偏大”、“偏小”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
某炔烃X加氢后,得CH3CH2CH(CH3)CH3,则X是()
A. 2﹣甲基﹣1﹣丁炔 B. 3﹣甲基﹣1﹣丁炔
C. 2﹣甲基﹣2﹣丁炔 D. 1﹣戊炔
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com