
| Kb(NH3•H2O) | 2×10-5mol•L-1 |
| Ka1(H2CO3) | 4×10-7mol•L-1 |
| Ka2(H2CO3) | 4×10-11mol•L-1 |
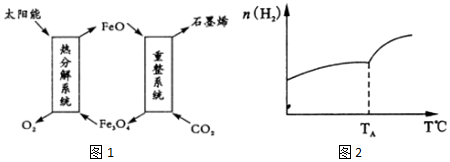
分析 (1)①Fe3O4的组分为Fe2O3•FeO,据此分析Fe的化合价;
②根据转化图分析,重整系统中FeO和CO2反应,生成Fe3O4和石墨烯(即C),据此写出反应的化学方程式;
(2)①原为按1molCO2和3molH2的物料比反应,其它条件不变,起始时若按lmolCO2、2molH2进行投料,相当于减小了反应物浓度,则化学平衡向逆反应方向移动,
②升高温度,H2达到平衡时的物质的量增大,升高温度,化学平衡向吸热方向移动;
③若测试中体系内无氧气产生,物质越稳定,越容易生成;
(3)①根据盖斯定律计算焓变;
②根据多重平衡规则计算反应的平衡常数K.
解答 解:(1)①Fe3O4的组分为Fe2O3•FeO,则Fe3O4中Fe的化合价是+2和+3,
故答案为:+3;
②根据转化图分析,重整系统中FeO和CO2反应,生成Fe3O4和石墨烯(即C),则重整系统发生反应的化学方程式为:6FeO+CO2═2Fe3O4+C,
故答案为:6FeO+CO2═2Fe3O4+C;
(2)①原为按1molCO2和3molH2的物料比反应,其它条件不变,起始时若按lmolCO2、2molH2进行投料,相当于减小了反应物浓度,则化学平衡向逆反应方向移动,CO2转化率将减小,
故答案为:减小;
②升高温度,H2达到平衡时的物质的量增大,升高温度,化学平衡向吸热方向移动,即逆反应方向,则正反应为放热反应,则△H<0,
故答案为:<;
③若测试中体系内无氧气产生,物质越稳定,越容易生成,产生1molC2H4的同时,产生4molC2H4,则热稳定性C2H4<H2O,
故答案为:<;
(3)①已知:①NH3•H2O(aq)?NH4+(aq)+OH-(aq)△H1=a kJ/mol,
②CO2 (g)+H2O(l)?H2CO3 (aq)△H2=bkJ/mol,
③H2CO3(aq)+OH-(aq)?HCO3-(aq)+H2O(l)△H3=ckJ/mol,
NH3•H2O吸收CO2制备NH4HCO3的化学方程式为:NH3•H2O+CO2═NH4++HCO3-,该反应可由①+②+③得到,根据盖斯定律,该反应的焓变△H=△H1+△H2+△H3=(a+b+c)kJ/mol,
故答案为:NH3•H2O+CO2═NH4++HCO3-△H=(a+b+c)kJ/mol;
②根据多重平衡规则,反应NH4++HCO3-+H2O?NH3•H2O+H2CO3的化学平常数为K=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{H}_{4}^{+})c(HC{O}_{3}^{-})}$=$\frac{c(N{H}_{3}•{H}_{2}O)c({H}_{2}C{O}_{3})}{c(N{H}_{4}^{+})c(HC{O}_{3}^{-})}$•$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{{K}_{w}}{{K}_{b}(N{H}_{3}•{H}_{2}O){K}_{a1}({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-14}}{2×1{0}^{-5}×4×1{0}^{-7}}$=1.25×10-3,
故答案为:1.25×10-3.
点评 本题考查化学原理部分知识,包含氧化还原反应方程式的书写和配平,热化学方程式的书写,盖斯定律的应用,化学平衡常数的计算,化学平衡的移动,均为高频考点,题目难度中等,试题有助于培养综合分析问题的能力,平时需加强综合能力的训练.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )
如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应.钠及其氧化物的物质的量均为0.1mol,水的质量为100g.下列说法正确的是( )| A. | 甲、乙、丙都属于氧化还原反应 | |
| B. | 甲反应的离子方程式为Na+2H2O═Na++2OH-+H2↑ | |
| C. | 甲、乙、丙充分反应后所得溶液的质量分数分别为w1、w2、w3,则2w1=w2=w3 | |
| D. | 丙充分反应,能产生0.05 mol O2,转移电子0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该反应过程中的能量变化如图所示 | |
| B. | 生成的过氧化钠属于碱性氧化物 | |
| C. | 反应中每消耗1molO2转移2mol电子 | |
| D. | 过氧化钠与氧化钠所含化学键完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )
如图是元素周期表的一部分,表格中所示元素均为前四周期的元素.X元素的非金属性在同周期中仅次于一种元素.下列说法中不正确的是( )| A. | X代表的元素处于第ⅥA族 | |
| B. | Y的最低负化合价是-3 | |
| C. | M元素的最高价氧化物对应的水化物的化学式是HMO3 | |
| D. | 气态氢化物的稳定性:N>Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+.已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )
氯酸钾和亚硫酸氢钾溶液能发生氧化还原反应:ClO3-+3HSO3-═3SO42-+Cl-+3H+.已知该反应的速率随c(H+)的增大而加快.下列为用ClO3-在单位时间内物质的量浓度变化表示的该反应v-t图.下列说法中不正确的是( )| A. | 反应开始时速率增大可能是c(H+)所致 | |
| B. | 纵坐标为v(Cl-)的v-t曲线与图中曲线完全重合 | |
| C. | 图中阴影部分的面积表示t1-t2时间内ClO3-的物质的量的减少量 | |
| D. | 后期反应速率下降的主要原因是反应物浓度减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

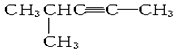 分子式为C5H8,名称是4-甲基-1-戊炔,
分子式为C5H8,名称是4-甲基-1-戊炔,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中加入稀氨水,水的电离平衡逆向移动,c(OH-)降低 | |
| B. | 向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 向水中加入少量CH3COOH,水的电离平衡逆向移动,c(H+)降低 | |
| D. | 将水加热,Kw增大,pH不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com