
分析 (1)①已知:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1①
NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1②
由盖斯定律可知,将①+②可得:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g);
②COCl2和液氨发生“复分解”反应生成尿素,还生成氯化铵;
(2)①△H-T△S<0的反应可自发进行;
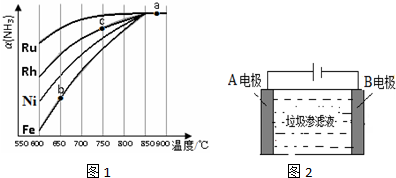
②由图可知,相同温度时Ru对应转化率最大;c点氨气的转化率高于b点,与温度有关;
(3)电解除去NH3,第一步电解产生氧化剂,可知A电解上氯离子放电生成氯气;第二步氧化剂氧化氨氮物质生成N2,为氯气氧化氨气生成氮气.
解答 解:(1)①已知:2NH3(g)+CO2(g)═NH2CO2NH4(s)△H=-159.47kJ•mol-1①
NH2CO2NH4(s)═CO(NH2)2(s)+H2O(g)△H=+72.49kJ•mol-1②
由盖斯定律可知,将①+②可得:2NH3(g)+CO2(g)═CO(NH2)2(s)+H2O(g)△H=(-159.47kJ•mol-1)+(+72.49kJ•mol-1)=-86.98KJ/mol,
故答案为:-86.98;
②由于液氨的电离方程式为2NH3(l)?NH2-+NH4+,COCl2和液氨发生“复分解”反应生成尿素,而尿素的化学式为CO(NH2)2,可知该反应的化学方程式为COCl2+4NH3=CO(NH2)2+2NH4Cl,
故答案为:COCl2+4NH3=CO(NH2)2+2NH4Cl;
(2)①△G=△H-T△S<0,反应可以自发进行,氨气分解为熵增的反应,且△H为增大反应,故反应在高温下可以自发进行,
故答案为:高温;
②根据图可知,在600℃时催化效果最好的是Ru,b、c点均未达到平衡,c点温度较高,反应速率较快,氨气的转化率较高,
故答案为:Ru;c点温度较高,反应速率较快,氨气的转化率较高;
(3)①根据图示知道:A电极是电解池的阳极,该电极上发生失电子的氧化反应,可以得到氧化剂,根据离子的放电顺序,即氯离子失电子产生氯气的过程,电极反应式为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
②第二步氧化剂氯气氧化氨氮物质即氨气生成N2的过程,发生的反应为3Cl2+2NH3=N2+6HCl,故答案为:3Cl2+2NH3=N2+6HCl.
点评 本题考查化学平衡图象、反应热与焓变、电解应用,为高频考点,把握盖斯定律的应用、图中温度和催化剂对平衡影响、电极反应为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:选择题
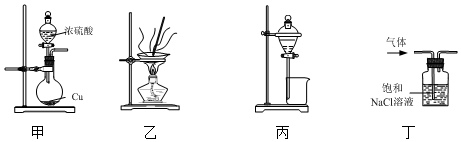
| A. | 用装置甲制取少量SO2 | |
| B. | 用装置乙蒸发FeCl3溶液制取FeCl3晶体 | |
| C. | 用装置丙分离CH3COOH和CH3COOCH2CH3的混合液 | |
| D. | 用装置丁除去Cl2中混有的少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属发生吸氧腐蚀时,被腐蚀的速率和氧气浓度无关 | |
| B. | 标准状况下,2.24LCCl4分子中共价键的数目为0.4×6.02×1023 | |
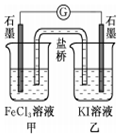
| C. | 控制适合的条件,将反应2Fe3++2I-═2Fe2++I2设计成如图所示的原电池.当电流汁读数为零后,在甲中溶入FeCl2固体,则乙中石墨电极为负极 | |
| D. | 向盛有2mL饱和H2S溶液的两支试管中分别滴加1滴浓度均为0.1mol/L的ZnSO4溶液和CuSO4溶液,有CuS生成而无ZnS生成,则Ksp(CuS)<Ksp(ZnS) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 | |
| B. | 在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 | |
| C. | 11.2 g Fe在高温下与足量水蒸气反应,生成的H2分子数目为0.3×6.02×1023 | |
| D. | 室温下,体积、pH均相同的HA和HB两种酸分别与足量的锌反应,HA放出的氢气多,说明酸性HB>HA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 灼热的碳与二氧化碳的反应 | |
| B. | 盐酸与烧碱溶液的反应 | |
| C. | 乙醇在空气中的燃烧 | |
| D. | 氢氧化钡晶体与氯化铵晶体在常温下的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuO中混有Al2O3:加入过量烧碱溶液充分反应后过滤 | |
| B. | FeCl2溶液中混有CuCl2:加入过量铁粉充分反应后过滤 | |
| C. | Na2CO3固体中混有少量NaHCO3:加入过量NaOH溶液,反应后加热蒸干 | |
| D. | 乙烷中混有乙烯:将混合气体通过盛溴水的洗气瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g) $?_{500℃、30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | 氯化镁溶液与氨水反应:Mg2++2NH3•H2O═Mg(OH)2↓+2NH4+ | |
| D. | 氧化铝溶于NaOH溶液:Al2O3+2OH-+3H2O═2Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
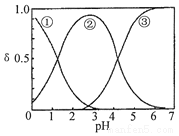 H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示,下列说法正确的是( )| A. | 曲线①代表的粒子是HC2O4- | |
| B. | 0.1mol•L-1NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) | |
| C. | pH=5时,溶液中主要含碳微粒浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) | |
| D. | 在一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com