
【题目】元素周期表的形式多种多样,如图是扇形元素周期表的一部分,对比中学常见元素周期表,思考扇形元素周期表的填充规律,下列说法正确的是
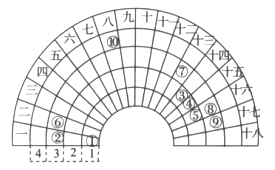
A. ②、⑧、⑨对应简单离子半径依次减小
B. 该表中标注的元素全部是主族元素
C. 元素⑥和⑦的原子序数相差11
D. ④的最高价氧化物对应的水化物能与其氢化物反应,生成离子化合物
科目:高中化学 来源: 题型:
【题目】对于可逆反应A(g)+3B(s) ![]() C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
C(g)+2D(g),在不同条件下的化学反应速率如下,其中表示的反应速率最快的是
A. v(A)=2 mol·L-1·min-1 B. v(B)=1.2 mol·L-1·s-1
C. v(C)=0.1 mol·L-1·s-1 D. v(D)=0.4 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知a、b、c的分子式均为C4H8O2,其结构简式如下图所示,下列说法正确的是
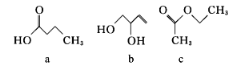
A. a、b均能使酸性KMnO4溶液褪色 B. a、b、c均可与氢氧化钠溶液反应
C. a、b、c中只有b的所有原子处于同一平面 D. c的二氯代物有六种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料知:Br2的沸点为58.8 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
Ⅰ.(1)常温下,单质溴通常呈________态,保存时通常在盛溴的试剂瓶中加入少量________。
Ⅱ.工业生产中,海水提取溴常用热空气吹出法。其生产流程如下:

某化学实验小组模拟该法设计了如下实验装置(夹持装置略去)从浓缩的海水中提取液溴。实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭a、c,打开b、d,向A中鼓入足量热空气;
③关闭b,打开a,再通过A向B中通入足量的Cl2;
④将B中所得液体进行蒸馏,收集液溴。

(2)当观察到A中液面上方出现________(实验现象)时即可判断步骤①中反应已经结束。
(3)X试剂可以是________(填字母,下同),尾气处理选用________。
a.H2O b.饱和食盐水 c.氢氧化钠溶液 d.饱和Na2SO3溶液
B中X试剂发生反应的离子方程式为________________________________。
(4)蒸馏时应该选择______(填序号),操作中应控制的关键实验条件为____________。

Ⅲ.该实验小组利用制得的单质溴研究H2与Br2生成HBr的反应,实验装置如下:

(5)E装置可用来检验反应产物HBr,则D装置的作用是_______。若要检验E中收集的HBr,图示装置检验HBr还不够完善,请结合原有实验装置予以改进:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL1.00mol·L-1HCl溶液和V2mL未如浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )

A. 做该实验时环境温度为22℃ B. 该实验表明化学能可以转化为热能
C. NaOH溶液的浓度约为1.00mol·L-1 D. 该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是硫酸工业尾气的主要成分。以硫酸工业的尾气联合制备硫酸钾和硫酸锰晶体(MnSO4·H2O)的工艺流程如下:

(1)反应Ⅰ的总化学方程式为_______________________________。
(2)反应Ⅱ需控制温度在60~70 ℃,其原因是_______________________。实验室控制温度在60~70 ℃的加热方法是________________。
(3)上述生产工艺中可循环使用的物质是________________。
(4)检验硫酸钾样品中是否含有氯化物杂质的实验操作是_______________________。
(5)已知软锰矿浆的主要成分是MnO2,则反应Ⅳ中氧化剂与还原剂的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在强碱性溶液中能大量共存的是
A.Mg2+、Na+、NO3-、SO42-B.Na+、K+、ClO-、I-
C.Na+、K+、HCO3-、SO42-D.Ba2+、Na+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香族化合物 A(C9H12O)常用于药物及香料的合成,A 有如下转化关系:
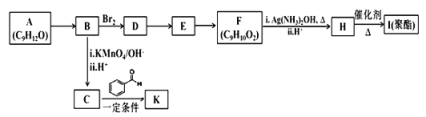
已知以下信息:①A 是芳香族化合物且分子侧链上有处于两种不同环境下的氢原子;
回答下列问题:
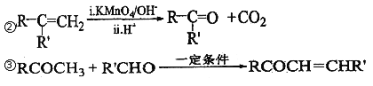
(1)B 生成 D 的反应类型为___________,由 D 生成 E 的反应所需的试剂及反应条件为_______。
(2)A 中含有的官能团名称为________________。
(3)K 的结构简式为________________________。
(4)由 F 生成 H 的反应方程式为________________________。
(5)F 有多种同分异构体,符合下列条件的同分异构体有__________种。
①属于芳香族化合物 ②能发生水解反应和银镜反应
(6)糠叉丙酮(![]() )是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(
)是一种重要的医药中间体,请参考上述合成路线,设计一条由叔丁醇[(CH3)3COH]和糠醛(![]() )为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
)为原料制备糠叉丙酮的合成路线(无机试剂任用,用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)。____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]硼及其化合物用途非常广泛,回答下列问题。
(1)下列B原子电子排布图表示的状态中,能量最低和最高的分别为________、________(填标号)
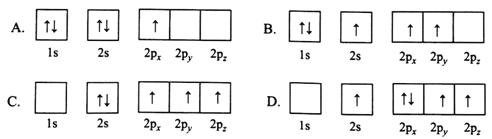
(2)H3BO3是一元弱酸,可用作医用消毒剂其水溶液呈酸性的原理为:
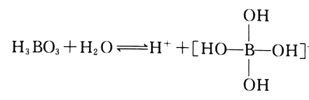
则1mol硼酸分子中含有的共用电子对数为________个。
(3)BF3可用于制造火箭的高能燃料,其分子的空间构型是________________,硼原子杂化方式是________________;BF3能与乙醚发生反应:(C2H5)2O+BF3→BF3·O(C2H5)2,该反应能发生,其原因是________________________________。
(4)硼的一种化合物结构简式为O=B—CH=C=CH2,该分子中含________个σ键。
(5)下图中图(a)为类似石墨的六方BN,图(b)为立方BN。
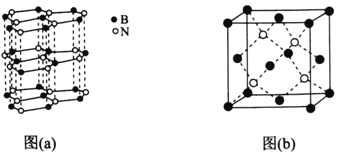
①六方BN具有良好的润滑性,是因为________________________;六方BN不能像石墨一样具有导电性,其原因是________________________。
②已知立方BN的晶胞参数为0.3615nm,阿伏加德罗常数的值为NA,则立方BN的密度为________________g·cm-3(列出计算式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com