
| 物质 | NaCl | NaHCO3 | NH4Cl |
| 40℃时溶解度/g | 37 | 13 | 46 |
| 10℃时溶解度/g | 33 |
分析 (1)根据40℃时NaCl的溶解度,可以计算出434 g食盐水中NaCl的质量和物质的量,计算44.8L(标准状况)NH3的物质的量,反应式NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl计算生成NaHCO3的质量和溶液中剩余的水的质量,再结合40℃时NaHCO3的溶解度计算可溶解NaHCO3的质量,析出NaHCO3的质量为生成的NaHCO3质量减去溶解的NaHCO3的质量;
(2)计算生成的NH4Cl质量和40℃时280.8 g水中可溶NH4Cl质量,比较二者的大小;
(3)根据10℃时NH4Cl的溶解度,计算280.8 g水中可溶NH4Cl质量,然后用生成的NH4Cl质量减去该部分质量即可;
(4)降温至10℃时,NH4Cl溶液已饱和,可加入NaCl粉末,从而增加Cl-离子浓度,使NH4Cl的溶解平衡向左移动.
解答 解:根据40℃时NaCl的溶解度,可以计算出434 g食盐水中NaCl的质量和物质的量:m(NaCl)=$\frac{37g}{137g}×434g$=117g,n(NaCl)=$\frac{117g}{58.5g/mol}$=2mol,
通入的NH3的物质的量:n(NH3)=$\frac{44.8L}{22.4L/mol}$=2mol,
由反应式NH3+NaCl+CO2+H2O=NaHCO3↓+NH4Cl可知各反应物和生成物之间物质的量相等的关系,
所以,可生成NaHCO3的质量:m(NaHCO3)=2 mol×84 g•mol-1=168 g,
溶液中剩余的水的质量为:m(H2O)=$\frac{434g×100g}{137g}$-2mol×18g/mol=280.8g,
这些水在40℃时可溶解NaHCO3的质量:m(NaHCO3)=$\frac{13g}{100g}×280.8g$=36.5g,
(1)析出NaHCO3的质量为:m(NaHCO3)=168 g-36.5 g=131.5 g,
答:可析出NaHCO3为131.5g;
(2)现有NH4Cl质量:m(NH4Cl)=2 mol×53.5 g•mol-1=107 g,40℃时,280.8 g水中可溶NH4Cl质量:$\frac{280.8g×46g}{100g}$=129.17g,因为129.17 g>107 g,所以NH4Cl不能析出,
答:NH4Cl不能析出;
(3)降温至10℃,可析出NH4Cl:m(NH4Cl)=2 mol×53.5 g•mol-1-$\frac{280.8g×33g}{100g}$=14.3g,
答:若降温至10℃,可析出NH4Cl14.3g;
(4)降温至10℃时,NH4Cl溶液已饱和,可加入NaCl粉末,搅拌使之溶解,从而增加Cl-离子浓度,使NH4Cl的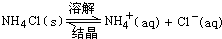 平衡向左移动,则可析出更多的NH4Cl晶体.
平衡向左移动,则可析出更多的NH4Cl晶体.
答:降温至10℃时,若要析出更多的NH4Cl晶体,可加入NaCl粉末.
点评 本题考查了化学方程式的计算和沉淀溶解平衡的移动,难度中等,计算过程较为复杂、计算量较大,注意解答过程的简洁和计算的准确性.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 温度/℃ | 400 | 500 | 800 | 1000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向偏铝酸钠溶液中加入过量盐酸:AlO2-+4H+=Al3++2H2O | |
| B. | MnO2与浓盐酸混合加热:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| C. | 等浓度等体积的Ba(OH)2溶液和NaHSO4溶液混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O | |
| D. | 用NaOH溶液吸收少量H2S气体:OH-+H2S=HS-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ①或② | C. | 只有④ | D. | ③或④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锡中加入一定量的铅制成焊锡,目的使被焊接的部分更牢固,更不易被氧化 | |
| B. | 聚乙烯制成塑料薄膜,用于食品、药品包装的材料 | |
| C. | 大量燃烧化石燃料是造成雾霾天气的一种重要因素 | |
| D. | 含重金属离子的电镀废液不能随意排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用有机溶剂从青蒿中提取青蒿素,主要采用萃取的方法 | |
| B. | 青蒿素的分子式为C15H22O5 | |
| C. | 青蒿素通过还原反应可制得双氢青蒿素 | |
| D. | 青蒿素和双氢青蒿素都是芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大 | B. | 减小 | C. | 不变 | D. | 不能确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com