
| A. | ①②③ | B. | ②③④ | C. | ①②④⑤ | D. | ①②③④⑤ |
分析 ①非金属性越强,最高价氧化物对应水合物的酸性越强;
②金属性越强,最高价氧化物对应水合物的碱性越强;
③同一周期中,原子序数越大,非金属性越强;
④同一周期中,原子序数越大,金属性越弱;
⑤非金属性越强,气态氢化物稳定性越强.
解答 解:①非金属性Cl>Br>I,则最高价氧化物对应水合物的酸性:HClO4>HBrO4>HIO4,故①正确;
②同一主族,原子序数越大,金属性越强,则金属性Ba>Mg>Be,则最高价氧化物对应水合物的碱性:Ba(OH)2>Mg(OH)2>Be(OH)2,故②正确;
③C、O、F位于同一周期,原子序数越大,非金属性越强,则非金属性F>O>C,故③错误;
④Al、Mg、Na位于同一正确,原子序数越大,金属性越弱,则金属性性:Al<Mg<Na,故④正确;
⑤非金属性F>Cl>S,则气态氢化物稳定性:HF>HCl>H2S,故⑤正确;
故选C.
点评 本题考查了原子结构与元素周期律的关系,题目难度中等,明确元素周期律的内容为解答关键,注意熟练掌握原子结构与元素周期律、元素周期表的关系.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 28 g C2H4和C4H8混合气体中含有氢原子总数为4NA | |
| B. | 常温常压下,Cu-Zn原电池中,正极产生1.12 L H2时,转移的电子数应小于0.1NA | |
| C. | 15g 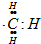 含有的电子数为9NA 含有的电子数为9NA | |
| D. | 2.1 g DTO中所含中子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤ | B. | ①③⑦ | C. | ①⑥⑦ | D. | ②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 编号 | ① | ② | ③ | ④ |
| 装置 |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+Cl2 (g)=2HCl(g)的反应热△H=2×E3-(E1+E2) | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaOH浓溶液滴加到饱和FeCl3溶液中制备Fe(OH)3胶体 | |
| B. | 用向上排空气法收集铜粉与稀硝酸反应产生的NO | |
| C. | 配制氯化铁溶液时,将氯化铁溶解在较浓的盐酸中再加水稀释 | |
| D. | 将Cl2与HCl混合气体通过饱和食盐水可得到纯净的Cl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:ClO->I2>SO42- | |
| B. | 蓝色消失的原因是Na2SO3溶液反应生成SO2具有漂白性 | |
| C. | 淀粉KI溶液变蓝是因为I-被ClO-氧化为I2,I2遇淀粉变蓝 | |
| D. | 若将Na2SO3溶液加入溴水,溴水褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
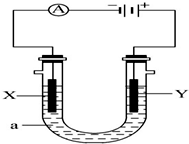 电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com