
| A. | 回收各种废弃塑料 | B. | 将用过的塑料袋立即焚烧 | ||
| C. | 使用可降解塑料 | D. | 用布购物袋替代一次性塑料购物袋 |
分析 白色污染是指用聚苯乙烯、聚丙烯、聚氯乙烯等高分子化合物制成的各类生活塑料制品使用后被弃置成为固体废物,要解决白色污染,要尽可能减少使用塑料品,回收废旧塑料,研制开发可降解塑料,不能焚烧,这样会造成二次污染,据此解答.
解答 解:A.回收利用各种废弃塑料,可以减少废塑料的丢弃,有利于减少白色污染,故A正确;
B.焚烧塑料产生烟雾和毒气,对环境造成二次污染,故B错误;
C.使用可降解塑料可以减少难降解塑料的使用,能够减少白色污染,故C正确;
D.用布袋代替塑料袋,因为布袋可降解,可以减少难降解塑料的使用,可以减少白色污染,故D正确;
故选:B.
点评 本题考查白色污染和防治,要明确白色污染主要指聚乙烯等塑料制品引起的污染,熟悉减少白色污染的方法和措施,有利于学生养成环境保护意识.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
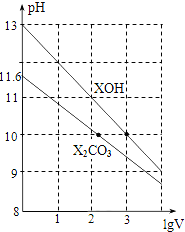
| A. | XOH是弱碱 | |
| B. | pH=10的两种溶液中的c(X+):XOH大于X2CO3 | |
| C. | 已知H2CO3的电离平衡常数Ka1远远大于Ka2,则Ka2约为1.0×10-10.2 | |
| D. | 当lgV=2时,若X2CO3溶液升高温度,溶液碱性增强,则$\frac{c(HC{O}_{3}^{-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | 1×10-13 | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 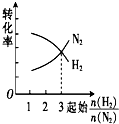 | B. | 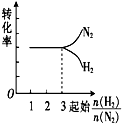 | C. | 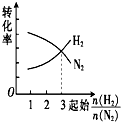 | D. | 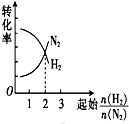 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-的结构示意图: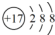 | B. | CCl4的电子式: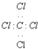 | ||
| C. | 丙烯的结构简式:CH3CH2CH2 | D. | 次氯酸的结构式:H-Cl-O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com