
 .
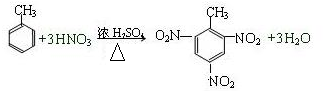
. 分析 (1)甲苯和浓硝酸、浓硫酸混合加热反应生成2,4,6-三硝基甲苯;
(2)乙烯和水一定条件下发生加成反应生成乙醇;
(3)2-溴丙烷在强碱溶液中发生水解反应生成醇和溴化钠;
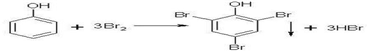
(4)苯酚与浓溴水的取代生成白色沉淀三溴苯酚和溴化氢.
解答 解:(1)甲苯和浓硝酸、浓硫酸混合加热反应生成2,4,6-三硝基甲苯,反应的化学方程式为: ,
,
故答案为: ;
;
(2)乙烯和水一定条件下发生加成反应生成乙醇,反应的化学方程式为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH,
故答案为:CH2=CH2+H2O$→_{△}^{催化剂}$CH3CH2OH;
(3)2-溴丙烷在强碱溶液中发生水解反应生成醇和溴化钠,反应的化学方程式为:(CH3)2CHBr+NaOH→(CH3)2CHOH+NaBr,
故答案为:(CH3)2CHBr+NaOH→(CH3)2CHOH+NaBr;
(4)苯酚与浓溴水的取代生成白色沉淀三溴苯酚和溴化氢,反应的化学方程式为: ,
,
故答案为: .
.
点评 本题考查了有机物化学性质、反应条件、反应产物和化学方程式书写方法等知识,掌握基础是解题关键,题目难度不大.


 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯乙烷与NaOH溶液共热,在反应后的溶液中加入AgNO3溶液检验Cl- | |
| B. | 在淀粉加入硫酸加热水解后的溶液中,直接加入银氨溶液,水浴加热,检验葡萄糖的生成 | |
| C. | 1 mol•L-1 CuSO4溶液2 mL和0.5 mol•L-1 NaOH溶液4 mL混合后加入40%的乙醛溶液0.5 mL,加热煮沸观察沉淀的颜色 | |
| D. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③ | C. | ①②③ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
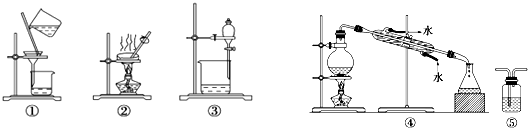
| A. | 用CCl4提取碘水中的碘,选③ | |
| B. | 用KMnO4溶液检验CH4是否含有C2H4,选⑤ | |
| C. | 粗盐提纯,选①和② | |
| D. | 石油的分馏,选④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验步骤 | 实验现象[ |
| ①将少量的氯水滴入到适量NaBr溶液中,再滴入少量的CCl4溶液并用力振荡 | A.溶液分为上下两层,上层为无色,下层为橙红色 |
| ②将少量的溴水滴入到适量KI溶液中,再滴入少量的CCl4溶液并用力振荡 | B.溶液分为上下两层,上层为无色,下层为紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
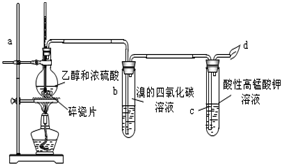
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯(CH2=CH-CH3)聚合后的结构简式: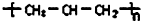 | |
| B. | 乙醇的结构式:CH3CH2OH | |
| C. | 四氯化碳分子的电子式为: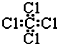 | |
| D. | 丙烷分子的球棍模型为: |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com