
【题目】 [物质结构与性质]
臭氧(O3)在[Fe(H2O)6]2+催化下能将烟气中的SO2、NOx分别氧化为![]() 和
和![]() ,NOx也可在其他条件下被还原为N2。
,NOx也可在其他条件下被还原为N2。
(1)![]() 中心原子轨道的杂化类型为___________;
中心原子轨道的杂化类型为___________;![]() 的空间构型为_____________(用文字描述)。
的空间构型为_____________(用文字描述)。
(2)Fe2+基态核外电子排布式为__________________。
(3)与O3分子互为等电子体的一种阴离子为_____________(填化学式)。
(4)N2分子中σ键与π键的数目比n(σ)∶n(π)=__________________。
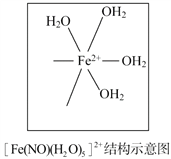
(5)[Fe(H2O)6]2+与NO反应生成的[Fe(NO)(H2O)5]2+中,NO以N原子与Fe2+形成配位键。请在[Fe(NO)(H2O)5]2+结构示意图的相应位置补填缺少的配体。
【答案】[物质结构与性质]
(1)sp3 平面(正)三角形
(2)[Ar]3d6或1s22s22p63s23p63d6
(3)NO2
(4)1∶2
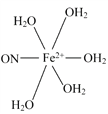
(5)
【解析】分析:(1)用价层电子对互斥理论分析SO42-中S的杂化方式和NO3-的空间构型。
(2)Fe原子核外有26个电子,根据构造原理写出基态Fe的核外电子排布式,进一步写出Fe2+的核外电子排布式。
(3)用替代法写出O3的等电子体。
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键。
N,三键中含1个σ键和2个π键。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子。
详解:(1)SO42-中中心原子S的价层电子对数为![]() (6+2-4
(6+2-4![]() 2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为
2)+4=4,SO42-中S为sp3杂化。NO3-中中心原子N的孤电子对数为![]() (5+1-3
(5+1-3![]() 2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
2)=0,成键电子对数为3,价层电子对数为3,VSEPR模型为平面三角形,由于N原子上没有孤电子对,NO3-的空间构型为平面(正)三角形。
(2)Fe原子核外有26个电子,根据构造原理,基态Fe的核外电子排布式为1s22s22p63s23p63d64s2,基态Fe2+的核外电子排布式为1s22s22p63s23p63d6。
(3)用替代法,与O3互为等电子体的一种阴离子为NO2-。
(4)N2的结构式为N![]() N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
N,三键中含1个σ键和2个π键,N2分子中σ键与π键的数目比为n(σ):n(π)=1:2。
(5)根据化学式,缺少的配体是NO和H2O,NO中N为配位原子,H2O中O上有孤电子对,O为配位原子,答案为: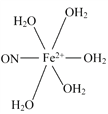 。
。


科目:高中化学 来源: 题型:
【题目】某实验小组利用稀硫酸与锌粒制取氢气的实验探究影响化学反应速率的因素,反应速率与反应时间的关系如图,请回答下列问题:
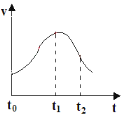
(1)t0~t1间反应速率增大的原因是___。
(2)若在t2时刻向溶液中加入少量CuSO4固体,反应速率明显加快,对此大家展开研究:
①有人认为是加入的SO42-催化了反应。他的观点___(填“正确”或“不正确”)。如何设计实验加以证明?___。
②有同学发现当加入较多CuSO4固体时,反应速率反而下降,可能的原因是___。
(3)如要加快t0时刻气体产生的速率,从反应物角度看,可采取的措施有___(至少答两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出260 kJ的热量(相当于25℃、101kPa下测得的热量)。
(1)反应的热化学方程式为___________。
(2)又已知H2O(l) = H2O(g) ΔH= +44kJ/mol。则16g液态肼与液态双氧水反应生成液态水时放出的热量是_____kJ。
(3)此反应用于火箭推进,其优点是(至少答两点)________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学使我们的生活更加美好。使用自热材料的暖贴、自热食品极大的方便了人们的生活。
(1)自热材料是利用化学反应原理,将_____能转化为热能供人们使用。一般利用原电池原理来_____(“加快”或“减慢”)放热速度。
(2)暖贴中自热材料的主要化学成分有:铁粉、炭粉、氯化钠固体、其他辅助成分及保温材料等,并用可控制氧气透过速率的无纺布包装。在工作时,铁粉与炭粉形成原电池反应,该反应过程中的能量变化关系图中,正确的是______。

(3)控制适当的氧气透过速率,使暖贴保持一个适合人体的温度,无纺布非常重要。制作无纺布的原料为丙烯,丙烯结构如图。关于丙烯分子内的相互作用有______。
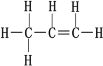
A.共价键 B.离子键 C.范德华力 D.氢键
(4)自热食品的自热材料中,除有暖贴当中的成分外,还有生石灰、铝粉、碳酸钠等,仍用无纺布包装。使用时先加适量的水。开始时有放热的非氧化还原反应发生,其化学方程式为_____。然后会形成强碱性溶液,并进一步发生剧烈反应,并产生一种易燃易爆的气体,大量放热,将食品煮熟。该反应的离子方程式为:_______。商家为保证迅速放热,采取了以下哪些加速反应的措施:_____。
①形成原电池反应 ②将铝粒制成铝粉 ③增大压强 ④使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在酸性条件下反应得到:

下列说法正确的是( )
A. X分子中所有碳原子可能共平面
B. X、Y分别与足量H2加成后的分子中均含有手性碳原子
C. Y可以发生显色、氧化和还原反应,还可以与甲醛发生缩聚反应
D. 等物质的量的X、Y分别与NaOH溶液反应,最多消耗NaOH的物质的量之比为4∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,在3支相同体积的试管中分别充有等体积混合的2种气体,它们是① NO和NO2,② NO2和O2,③ NH3和N2。现将3支试管均倒置于水槽中,充分反应后,试管中剩余气体的体积分别为V1、V2、V3,则下列关系正确的是
A.V1>V2>V3B.V1>V3>V2C.V2>V3>V1D.V3>V1>V2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人民网报道:在巴勒斯坦已故领导人阿拉法特的遗物中检出超过正常标准的高放射性元素![]() Po。下列有关叙述正确的是( )
Po。下列有关叙述正确的是( )
A.Po的相对原子质量为210
B.![]() Po与
Po与![]() Po互为同素异形体
Po互为同素异形体
C.Po位于第六周期ⅥA族
D.![]() Po原子核内的中子数为84
Po原子核内的中子数为84
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯的产量通常用来衡量一个国家的石油化工水平,某化学实验小组为了探究石蜡油(17个碳以上的液态烷烃混合物)分解产物中有乙烯存在,设计了如下实验方案:
(查阅资料可知:乙烯与酸性高锰酸钾溶液反应产生二氧化碳。)
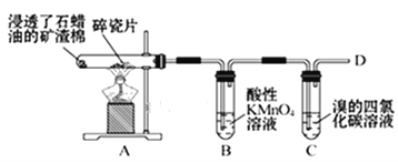
(1)乙烯的结构式是___。
(2)B中实验现象:___。
(3)C中发生反应的化学方程式:__,反应类型:___。
(4)通过上述实验探究可知,除去乙烷中混有的乙烯,可以选择的试剂是___。
A.水 B.溴水
C.氢氧化钠溶液 D.酸性高锰酸钾溶液
(5)关于乙烯,下列说法中不正确的是___。
A.聚乙烯塑料可以用做食品包装袋
B.乙烯在一定条件下可以和水反应制乙醇
C.乙烯分子中所有原子不共面
D.乙烯是一种植物生长调节剂,可以延长果实和花朵的成熟期
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com