
 .
.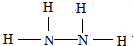 .
.分析 A是原子半径最小的元素,应为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,电子排布为1s22s22p2,为C元素,D原子的核外成对电子数是未成对电子数的3倍,为O元素,轨道表达式为 ,则C为N元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,为HCHO,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,为苯,结合对应物质的性质以及题目要求解答该题.
,则C为N元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,为HCHO,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,为苯,结合对应物质的性质以及题目要求解答该题.
解答 解:A是原子半径最小的元素,应为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,电子排布为1s22s22p2,为C元素,D原子的核外成对电子数是未成对电子数的3倍,为O元素,轨道表达式为 ,则C为N元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,为HCHO,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,为苯,
,则C为N元素;E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,E原子核外电子数为18+4=22,故E为Ti,A、B、D三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,为HCHO,A、B两种元素组成的原子个数之比为1:1的化合物N是常见的有机溶剂,为苯,
(1)E为Ti元素,原子核外电子数为22,基态原子的外围电子排布式为:1s22s22p63s23p63d24s2,价电子排布式为3d24s2,C为O元素,轨道表达式为 ,
,
故答案为:3d24s2; ;
;
(2)N原子最外层p电子半满,为稳定结构,非金属性强的第一电离能大,则第一电离能由小到大的顺序为C<O<N,故答案为:C<O<N;
(3)周期表中同周期元素从左到右电负性逐渐增强,同主族从上到下电负性逐渐减小,则电负性最大的为O,O原子核外有8个电子,运动状态各不相同,
故答案为:O;8;
(4)H-C≡CC-H中含有3个σ键,2个π键,则比值为3:2,故答案为:3:2;
(5)a. M为HCHO,分子中含有3个σ键,故a错误;
b. N为苯,分子中含有极性键和非极性键,C-H键为极性键,C-C键为非极性,故b正确;
c.非金属性N>C,元素的非金属性越强,对应的氢化物越稳定,故c错误;
d. CO2为直线形分子,键角为180°,故正确.
故答案为:bd;
(6)①该氮氢化合物中N(H)=$\frac{32×12.5%}{1}$=4,故分子中N(N)=$\frac{32-4}{14}$=2,该氮氢化合物为N2H4,分子中氢原子之间形成1对共用电子对,氢原子与氮原子之间形成1对共用电子对,其电子式为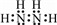 ,结构式为
,结构式为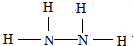 ,
,
故答案为: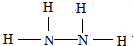 ;
;
②N2H4与液态双氧水恰好完全反应,产生两种无毒又不污染环境的物质,则生成氮气与水,该反应化学方程式为:N2H4+2 H2O2═N2↑+4H2O,
故答案为:N2H4+2 H2O2═N2↑+4H2O.
点评 本题考查位置、结构与性质的关系及应用,为高频考点,把握元素的位置、性质推断元素为解答的关键,侧重分析、推断及应用能力的综合考查,(5)为解答的难点,题目难度中等.


科目:高中化学 来源: 题型:解答题

| 离子 | Ca2+ | Fe3+ |
| 完全沉淀时的pH | 13 | 3.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
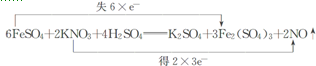 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气可用于制漂白粉 | B. | 液氨可用作制冷剂 | ||
| C. | 活性炭可以去除冰箱中的异味 | D. | 二氧化硅可做半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
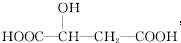
| A. | 苹果酸中能发生酯化反应的官能团有1种 | |
| B. | 1 mol苹果酸可与3 mol NaHCO3发生中和反应 | |
| C. | 1 mol苹果酸与足量金属 Na反应生成生成mol H2 | |
| D. | 1 mol苹果酸可以形成三元或四元环状内酯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com