
【题目】容积均为2L的甲乙丙三个恒容密闭容器中均加入0.10mol/L的N2、0.26mol/L的H2,进行合成氨反应:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol。图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数。
2NH3(g) △H=-92.4kJ/mol。图1表示不同反应条件下N2的浓度随时间的变化,图2表示其它条件相同,温度分别为T1、T2、T3且恒定不变,达到平衡时NH3的质量分数。
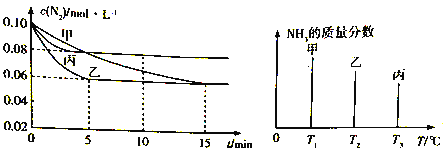
下列判断不正确的是
A. 图2 中反应速率最快的是容器丙
B. 图1 中容器乙的反应可能使用了催化剂
C. 图l 中容器乙0~5 min时间内v(N2) = 0.012mol/(L·min)
D. 图1 中容器丙内反应的平衡常数为2.5
科目:高中化学 来源: 题型:
【题目】关于如图所示各装置的叙述中,正确的是

A. 装置①是原电池,总反应是:Cu+2Fe3+=Cu2++2Fe2+
B. 装置①中,铁作负极,电极反应式为:Fe3++e-=Fe2+
C. 装置②通电一段时间后石墨Ⅱ电极附近溶液红褐色加深
D. 若用装置③精炼铜,则d极为粗铜,c极为纯铜,电解质溶液为CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向一定体积0.1 mol/L氨水中逐滴加入等浓度的盐酸,溶液中pH与pOH的变化关系如右图所示。下列说法错误的是( )
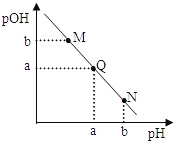
A. 此温度下,水的离子积常数为1.0×10 -2a
B. N点溶液加水稀释,![]() 增大
增大
C. M、Q、N三点所示的溶液中,c(NH4+)+c(H+)=c(OH-)+c(Cl-)
D. Q点消耗的盐酸的体积等于氨水的体积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH4+、Fe2+、SO42﹣、CO32﹣
B.在含有大量Ba2+ 的溶液中:NH4+、Na+、Cl﹣、CO32﹣
C.在强碱性溶液中:Na+、Cl﹣、K+、SO42﹣
D.在强酸性溶液中:K+、Fe2+、Cl﹣、HCO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖是人体重要的营养物质。下列有关的叙述正确的是 ( )
A. 葡萄糖是一种碳水化合物,可以被浓硫酸吸水炭化
B. 葡萄糖是一种已糖
C. 葡萄糖经过水解才能被人体吸收
D. 葡萄糖是所有单糖中最简单的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是工业海水提溴的部分流程,下列有关说法正确的是
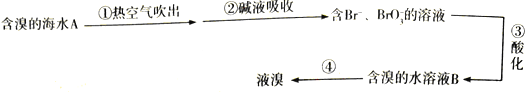
A. “吹出”采用热空气而不是常温空气的原因是热空气氧化性强
B. 碱液吸收所发生的化学反应中氧化剂与还原剂之比为1 : 5
C. 第③ 步中“酸化”要用强氧化性的酸,如硝酸
D. 含溴的水溶液B中的单质溴浓度比A中的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅酸盐在地壳中分布很广,可用蛭石生产硫酸镁和氢氧化镁。某地蛭石的主要成分是[(Mg2.36Fe0.48Al0.16)(Si2.72Al1.28)O10(OH)2] ·[Mg0.32(H2O)0.42],还含有少量杂质FeO。
实验步骤如下:
Ⅰ.制取粗硫酸镁:用硫酸浸泡蛭石矿粉,过滤,将滤液结晶得到粗硫酸镁。
Ⅱ.提纯粗硫酸镁:将粗硫酸镁在酸性条件下溶解,加入适量的0.1mol·L—1H2O2溶液,再加试剂A调节溶液pH,并分离提纯。
Ⅲ.制取氢氧化镁:向步骤Ⅱ得的溶液中加入过量氨水。
一些金属离子转化为氢氧化物沉淀时溶液的pH如表1所示
表1
Fe3+ | Al3+ | Fe2+ | Mg2+ | |
开始沉淀时 | 1.5 | 3.3 | 6.5 | 9.4 |
完全沉淀时 | 3.7 | 5.2 | 9.7 |
请回答:
(1)在步骤Ⅱ中加H2O2溶液的目的是___________。调节溶液pH的范围是______________。试剂A的最佳选择是_________(填字母序号)。
A、MgO B、Na2CO3 C、蒸馏水 D、稀硫酸
(2)测定粗硫酸镁中Fe2+的含量。称取12.3g粗硫酸镁样品溶于水形成溶液,完全转移到锥形瓶中,加稀硫酸酸化,滴加几滴黄色铁氰化钾K3[Fe(CN)6]溶液,用0.010 mol·L—1H2O2溶液进行滴定。平行测定4组,消耗H2O2溶液的体积数据记录如表2所示。
表2
实验编号 | 1 | 2 | 3 | 4 | 平均值 |
消耗H2O2溶液的体积/mL | 12.49 | 12.50 | 13.62 | 12.51 |
①K3[Fe(CN)6]与Fe2+反应生成带有特征蓝色的铁氰化亚铁沉淀,请写出反应的离子方程:________。
②反应达到终点时的标志是_________________________________________________。
③根据表2数据,可计算出粗硫酸镁样品中含有Fe2+_______________mol。
(3)工业上常以Mg2+的转化率为考查指标来确定步骤Ⅲ制备氢氧化镁工艺过程的适宜条件。
①步骤Ⅲ中制备氢氧化镁反应的离子方程式为_________________________。
②已知25℃时,Mg(OH)2和Ca(OH)2的Ksp分别为2×10-11和4.7×10—6。若用石灰乳替代氨水,__________(填“能”或“不能”)制氢氧化镁,理由是_____________________________。
③通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,Mg2+完全沉淀时溶液的pH为________。(保留小数点后一位)(已知lg2=0.3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液pH增大
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 负极反应为2H2O–4e–=O2+4H+,负极区溶液pH降低
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com