
| 实验事实 | 结论 | |
| A | 向某溶液中滴入2滴KSCN溶液,溶液不显血红色.再向溶液中滴入几滴新制的氯水,溶液变为血红色 | 该溶液中一定含有Fe2+ |
| B | 将CO2通入到Na2SiO3溶液中产生白色浑浊 | 酸性:H2CO3>H2SiO3 |
| C | 已知反应5Cl2+I2+6H2O═2HIO3+10HCl,2BrO3-+Cl2═2ClO3-+Br2 | 氧化性强弱顺序:BrO3->Cl2>2ClO3->IO3- |
| D | 测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,后者较大 | 非金属性:S>C |
| A. | A | B. | B | C. | C | D. | D |
分析 A.滴入2滴KSCN溶液,溶液不显血红色,可知不含铁离子,再向溶液中滴入几滴新制的氯水,溶液变为血红色,可知亚铁离子被氧化;
B.CO2通入到Na2SiO3溶液中产生白色浑浊,生成硅酸沉淀,为强酸制取弱酸;
C.氧化剂的氧化性大于氧化产物的氧化性;
D.测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,对应酸的酸性越弱,水解程度越大,pH越大.
解答 解:A.滴入2滴KSCN溶液,溶液不显血红色,可知不含铁离子,再向溶液中滴入几滴新制的氯水,溶液变为血红色,可知亚铁离子被氧化,则该溶液中一定含有Fe2+,故A正确;
B.CO2通入到Na2SiO3溶液中产生白色浑浊,生成硅酸沉淀,为强酸制取弱酸,则酸性:H2CO3>H2SiO3,故B正确;
C.氧化剂的氧化性大于氧化产物的氧化性,则氧化性强弱顺序:BrO3->Cl2>>IO3-,故C错误;
D.测定等物质的量浓度的Na2SO4与Na2CO3溶液的pH,对应酸的酸性越弱,水解程度越大,pH越大,则酸性为硫酸大于碳酸,可知非金属性:S>C,故D正确;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握离子检验、酸性比较、氧化性比较、盐类水解、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,5.6L甲烷中的共价键数目 | |
| B. | 标准状况下,17gND3中所含分子数目 | |
| C. | 向0.2 mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 | |
| D. | 0.1mol羟基(-OH)中所含电子数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
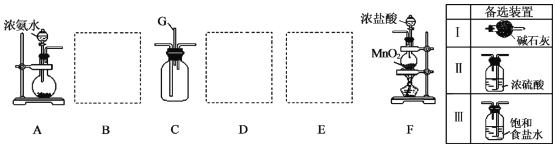
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.20 mol•L-1 | B. | 0.25 mol•L-1 | C. | 0.225 mol•L-1 | D. | 0.45 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
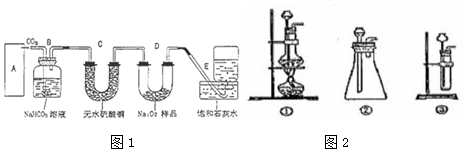
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
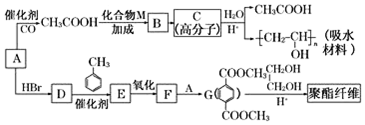
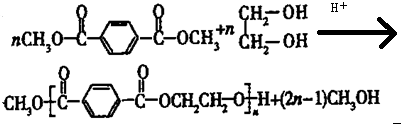 .
. 合成
合成  的流程图(注明反应条件)
的流程图(注明反应条件) .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com