
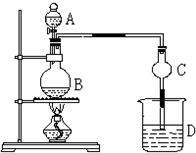
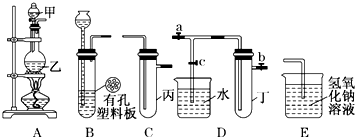
 某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题:
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸,D中放有饱和碳酸钠溶液.(已知:无水氯化钙可与乙醇形成难溶于水的CaCl2?6C2H5OH)请回答下列问题: CH3CO18OC2H5+H2O,
CH3CO18OC2H5+H2O, CH3CO18OC2H5+H2O;
CH3CO18OC2H5+H2O;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 元素 | 性质 |
| A | 一种核素的原子核内不含中子 |
| B | 原子核外电子有6种不同运动状态 |
| C | 最高价氧化物的水化物与其氢化物可发生非氧化还原反应 |
| D | 单质之一为淡蓝色气体,可阻挡对人体有害的紫外线 |
| E | 在地壳中的含量位居第三 |
| F | 周期表中位于短周期,基态原子M层成对电子数是未成对电子数的2倍 |
| G | 该元素的一种氧化物M可用作油漆颜料,与E的单质反应可应用于焊接钢轨 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、醋酸钠的水解反应:CH3COO-+H3O+?CH3COOH+H2O |
| B、稀H2SO4与足量Ba(OH)2溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| C、Fe(OH)3沉淀中加入足量HI:Fe(OH)3+3H+=Fe3++3H2O |
| D、AlCl3溶液中与过量氨水混合:Al3++3NH3?H2O=3NH4++Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||||
B、
| ||||
| C、Na和K属于ⅠA族元素,Na的金属性比K强 | ||||
| D、Cl和Br属于VⅡA族元素,两原子核外电子数之差为8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
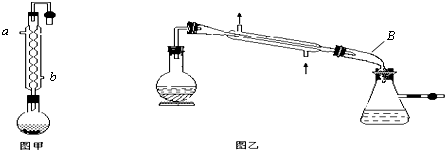
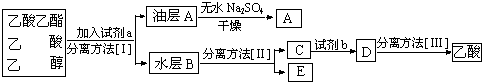
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | 实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气泡产生 | 氯气与水反应的产物具有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
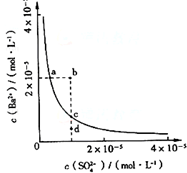
| A、加入Na2SO4可以使溶液由a点变到b点 |
| B、通过蒸发可以使溶液由d点变到c点 |
| C、a、b、c、d点溶液中Kw相等 |
| D、a点对应的Ksp大于c点对应的Ksp |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、10到15秒内c(NH3) 增加量等于0.25mol?L-1 |
| B、10秒内氨气的平均反应速率为0.025mol?L-1?s-1 |
| C、达平衡后,分离出少量NH3,v正增大 |
| D、该反应的逆反应的活化能不小于92.2kJ?mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
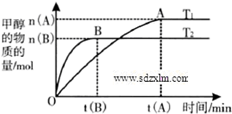 到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.
到2013午云南已连续4年干旱,专家认为云南和其他城市一样受到全球变暖的气候变化影响.CO2等温室气体是导致全球变暖的主要原因,控制和治理CO2是解决温室效应的有效途径.| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com