

分析 非金属元素的原子最外层电子数一般多于四个,元素名称汉字中一般是石字旁,三点水等,可以根据汉字来确定元素种类;
最外层电子数决定元素的化学性质;
具有稳定电子层结构的是最外层电子数为8的结构;
原子的核内质子数=核外电子数;阳离子的核内质子数>核外电子数;阴离子的核内质子数<核外电子数;
元素是具有相同核电荷数(即核内质子数)的一类原子的总称,故可知同种元素的原子具有相同的质子数.
解答 解:非金属元素的原子最外层电子数一般多于四个,元素名称汉字中一般是石字旁,三点水等,可以根据汉字来确定元素种类,所以B是氧元素、D硫元素,属于非金属元素;
最外层电子数决定元素的化学性质,BD最外层电子数相等,所以化学性质相似的是BD;
具有稳定电子层结构的是最外层电子数为8的结构,所以C是具有稳定电子层结构;
C中的核内质子数=11>核外电子数=10,属于阳离子;
元素是具有相同核电荷数(即核内质子数)的一类原子的总称,故可知同种元素的原子具有相同的质子数,其中A和C的质子数为11,属于同种元素;
故答案为:BD;BD;C;C;AC.
点评 本题考查的是元素的概念,原子结构示意图和离子结构示意图,题目难度不大,学习中注意相关基础知识的积累.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 所含原子个数之比为4:3 | B. | 所含离子个数之比为4:3 | ||
| C. | 所含氧原子个数之比为2:1 | D. | 所含钠的质量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 的系统命名4-甲基-2-乙基-1-戊烯.
的系统命名4-甲基-2-乙基-1-戊烯.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生成56.0LN2(标准状况) | |
| B. | 有0.300molKNO3被氧化 | |
| C. | 被氧化的N原子的物质的量为4.75mol | |
| D. | 转移电子的物质的量为1.50mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
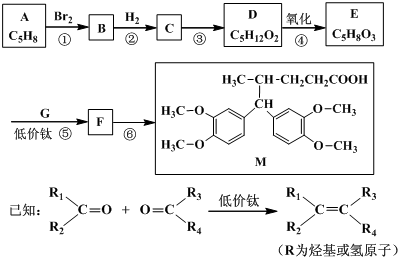
 (其中之一);.
(其中之一);. 或
或 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出).
A、B、C、D、E、F六种物质的转化关系如图所示(反应条件和部分产物未标出). ;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O.
;反应④的化学方程式为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+4NO2↑+2H2O. ,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.
,反应①的化学方程式为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com