
 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
在a LAl2(SO4)3和(NH4)2SO4的混合物溶液中加入b molBaCl2,恰好使溶液中的SO42-离子完全沉淀;如加入足量强碱并加热可得到c molNH3气,则原溶液中的Al3+离子浓度(mol/L)为 ( )
A.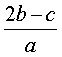 B.
B.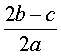 C.
C.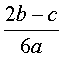 D.
D. 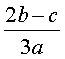
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质的保存方法正确的是 ( )
①少量金属钠保存在酒精中 ②浓硝酸盛放在无色试剂瓶中 ③少量白磷保存在水中 ④氢氟酸保存在带塑料盖的密封玻璃瓶中 ⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡皮塞的细口瓶中
A.③ B.③④⑥ C.②③④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
某液态卤代烷RX(R是烷基,X是某种卤素原子)的密度是a g·cm-3。该RX可以跟稀碱发生水解反应生成ROH(能跟水互溶)和X-。为了测定RX的分子量,拟定的实验步骤如下:①准确量取该卤代烷b mL,放入锥形瓶中。
②在锥形瓶中加入过量稀NaOH溶液,塞上带有长玻璃管的塞子,加热,发生反应。
③反应完成后,冷却溶液,加入稀硝酸酸化,滴入过量的AgNO3溶液,得到白色沉淀
④过滤、洗涤、干燥后称重,得到固体c g。回答问题:
(1)装置中长玻璃管的作用是________________。
(2)步骤④中,洗涤的目的是为了除去沉淀上吸附的________离子。
(3)该卤代烷中所含卤素的名称是____________,判断的依据是_____________。
(4)该卤代烷的分子量是_____________(列出算式)。
(5)如果在步聚③中,加HNO3的量不足,则步骤④中测得的c值将_______。
A.偏大 B.偏小 C.不变 D.大小不定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作所用仪器合理的是
A. 用100 mL 容量瓶配制所需的95 mL 0.1 mol·L-1 NaOH溶液
B. 用50mL烧杯准确量取30.5 mL NaOH溶液
C. 用托盘天平称取25.30gNaCl
D. 用50 mL 量筒量取4.8 mL浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下列化学方程式:(1)2KI+Cl2=2KCl+I2 (2)2FeCl2+Cl2=2FeCl3
(3)2FeCl3+2HI=2FeCl2+I2+2HCl (4)I2+SO2+2H2O=H2SO4+2HI
判断下列微粒氧化性强弱顺序正确的是
A.Cl2 > Fe3+ > SO2 > I2 B. Cl2 > Fe3+ >I2 >SO2
C. Cl2 > I2 > Fe3+ > SO2 D.Fe3+ > I2 > Cl2 > SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
阿伏加德罗常数约为6.02×1023 mol-1。下列叙述中正确的是( )
A.标准状况下,2.24L苯中约含有3.612×1023个碳原子
B.常温常压下,氧气和臭氧的混合物16g中约含有6.02×1023个氧原子
C.25℃时,1L pH=13的氢氧化钠溶液中约含有6.02×1023个氢氧根离子
D.1 molCH4中约含有3.01×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作和对应的现象、结论都正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 将饱和FeCl3溶液滴入沸水中 | 溶液变红褐色 | 有Fe(OH)3生成 |
| B | 用燃烧的镁条引燃铝热剂 | 剧烈反应 | 该反应是吸热反应 |
| C | 向溶液中滴加盐酸酸化的BaCl2溶液 | 产生白色沉淀 | 溶液中含有SO42- |
| D | 用导线连接铜片和锌片后插进盐酸中 | 铜片上有气泡 | 铜片是原电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
铝合金在日常生活、建筑装潢、航空航天和汽车制造等方面均有着广泛的用途。下列关于铝合金具有广泛用途的分析不正确的是
A.铝元素在地壳中的含量高,储量丰富
B.铝化学性质稳定,常温下不与任何酸碱反应
C.铝容易形成致密的氧化膜,抗腐蚀性能好
D.铝的冶炼技术基本成熟,可以大量生产
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com