
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH | ||
| C. | 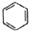 +HNO3$→_{50-60℃}^{浓硫酸}$ +HNO3$→_{50-60℃}^{浓硫酸}$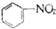 +H2O +H2O | D. | nCH2=CH2$\stackrel{一定条件}{→}$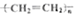 |
分析 A.光照下甲烷发生取代反应;
B.乙烯中含碳碳双键,与水发生加成反应;
C.苯与硝酸发生取代反应生成硝基苯;
D.乙烯发生加成反应生成聚乙烯,聚乙烯中不含碳碳双键.
解答 解:A.光照下甲烷发生取代反应,反应为CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl,故A正确;
B.乙烯中含碳碳双键,与水发生加成反应,加成反应为CH2=CH2+H2O$\stackrel{催化剂}{→}$CH3CH2OH,故B正确;
C.苯与硝酸发生取代反应生成硝基苯,取代反应为 +HNO3$→_{50-60℃}^{浓硫酸}$
+HNO3$→_{50-60℃}^{浓硫酸}$ +H2O,故C正确;
+H2O,故C正确;
D.乙烯发生加成反应生成聚乙烯,聚乙烯中不含碳碳双键,则加聚反应为nCH2=CH2$\stackrel{一定条件}{→}$ ,故D错误;
,故D错误;
故选D.
点评 本题考查有机物的结构与性质及有机反应方程式书写,为高频考点,把握有机物官能团与性质的关系、反应类型与反应条件为解答的关键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙显红色的溶液中大量存在:Mg2+、Na+、Cl-、F- | |
| B. | 标准状况下,46gNO2和N2O4混合气体中含有原子个数为3NA | |
| C. | 1L0.5mol•L-1 CuSO4溶液中含有0.5NA个Cu2+ | |
| D. | 浓度均为0.1 mol/L的氨水和盐酸、由水电离出的c(H+):盐酸>氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某种核素的相对原子质量 | |
| B. | 某种核素的质量数 | |
| C. | 某种元素所有核素质量数的平均值 | |
| D. | 某种元素的平均相对原子质量的近似值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径和简单离子半径减小 | |
| B. | 氧化物对应的水化物碱性减弱,酸性增强 | |
| C. | 14号元素的高纯单质可制光电池 | |
| D. | 单质的熔点降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
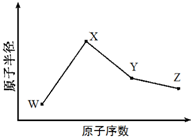 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.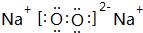 (写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式). .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com