
| 2min | 4min | 6min | 8min | … | |
| CO | 0.07 | 0.06 | 0.06 | 0.05 | … |
| H2 | x | 0.12 | 0.12 | 0.20 | … |
| CH3OH | 0.03 | 0.04 | 0.04 | 0.05 | … |
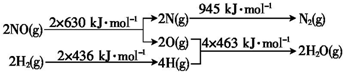 H2还原NO生成氮气和水蒸气的热化学方程式是
H2还原NO生成氮气和水蒸气的热化学方程式是| c(CH3OH) |
| c(CO)?c2(H2) |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.04 |
| 0.06×0.122 |
| 0.04 |
| 0.06×0.122 |
| c(CH3OH) |
| c(CO)?c2(H2) |
| 0.05 |
| 0.05×0.22 |
| 1 |
| 0.04 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:
X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:| 元素代号 | X | Y | Z | M | Q | R |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.037 |
| 主要化合价 | +2 | +3 | +6,-2 | +2 | -2 | +1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用天然气代替含硫的煤作燃料,可减少废气中二氧化硫的量 |
| B、臭氧含量过高的空气不利于人体健康 |
| C、溶有大量二氧化碳的降水通常称为酸雨 |
| D、废电池必须回收处理的原因是防止重金属离子污染环境 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯和苯的分子结构均含有碳碳双键 |
B、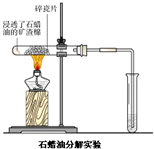 如图石蜡油分解产生的气体只有乙烯,能使溴的CCl4溶液褪色 |
| C、乙烯的产量可以用来衡量一个国家的石油化工生产水平 |
| D、工业常用乙烯与水发生加成反应生产食用酒精 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 COOH
COOH查看答案和解析>>
科目:高中化学 来源: 题型:
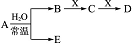 已知由 C、N、O、Na、Fe五种元素组成的常见单质或化合物存在如图所示转化关系(部分生成物和反应条件略去).
已知由 C、N、O、Na、Fe五种元素组成的常见单质或化合物存在如图所示转化关系(部分生成物和反应条件略去).查看答案和解析>>
科目:高中化学 来源: 题型:
| A、30mL | B、110mL |
| C、90mL | D、180mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
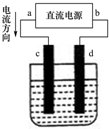
| A、电解过程中,d电极质量增加 |
| B、d为阳极,电极反应为:2Cl--2e-=Cl2↑ |
| C、a为负极、b为正极 |
| D、电解过程中,氯离子浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl难溶于水,溶液中没有Ag+和Cl- |
| B、AgCl沉淀生成和溶解同时在不断进行,且速率相等 |
| C、向AgCl溶液中加入盐酸,一定会有沉淀生成 |
| D、向含有AgCl的悬浊液中加入NaBr固体,AgCl沉淀不变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com