
 .
.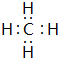
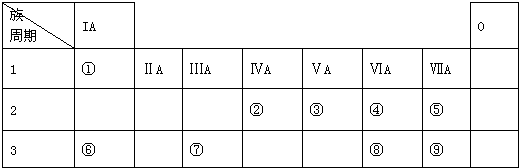
分析 (1)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S,⑨为Cl;
(2)⑦为Al元素,原子核内有13个质子,核外有3个电子层,各层电子数为2、8、3;
(3)①与②元素形成的最简单的有机物为CH4;
(4)同主族自上而下,元素非金属性减弱;
(5)同周期自左而右,元素金属性减弱;
(6)钠与氧气在加热条件下生成Na2O2.
解答 解:(1)由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为F、⑥为Na、⑦为Al、⑧为S,⑨为Cl.故答案为:N;
(2)⑦为Al元素,原子核内有13个质子,核外有3个电子层,各层电子数为2、8、3,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(3)①与②元素形成的最简单的有机物为CH4,电子式为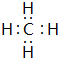 ,故答案为:
,故答案为: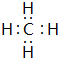 ;
;
(4)同主族自上而下,元素非金属性减弱,故非金属性⑤>⑨,故答案为:>;
(5)同周期自左而右,元素金属性减弱,故金属性Na>Al,故答案为:Na;
(6)钠与氧气在加热条件下生成Na2O2,反应方程式为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2,故答案为:2Na+O2$\frac{\underline{\;\;△\;\;}}{\;}$Na2O2.
点评 本题考查元素周期表与元素周期律,侧重对元素周期律与化学用语的考查,比较基础.


科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有8个σ键,1 个π键 | |
| B. | 丙烯分子中3个碳原子都是sp3杂化 | |
| C. | 丙烯分子不存在非极性键 | |
| D. | 丙烯分子中3个碳原子可能在同一直线上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
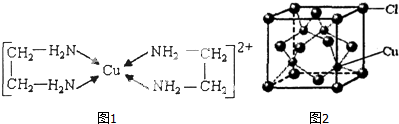
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只要是甜的物质,都是糖类 | |
| B. | 单糖是不能发生水解的最简单的糖类 | |
| C. | 淀粉纤维素都是天然有机高分子化合物 | |
| D. | 蔗糖和麦芽糖均为二糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广碳捕集和存储技术,逐步实现二氧化碳零排放 | |
| B. | 对工业废水、生活污水净化处理,减少污染物的排放 | |
| C. | 加大铅蓄电池、含汞锌锰干电池的生产,满足消费需求 | |
| D. | 加大清洁能源的开发利用,提高资源的利用率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 汽油是含有C5~C11的烷烃,可以通过石油的分馏得到汽油 | |
| B. | 含C18以上烷烃的重油经过催化裂化可以得到汽油 | |
| C. | 取等质量的乙烯和聚乙烯完全燃烧后,生成的CO2和H2O的质量分别相等 | |
| D. | 煤含有苯和甲苯,可用先干馏后分馏的方法将它们分离出来 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去乙烷中少量的乙烯:光照条件下通入Cl2,使乙烯转化成液态二氯乙烷而与乙烷分离 | |
| B. | 除去乙醇中少量的乙酸:加足量生石灰,蒸馏 | |
| C. | 除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶 | |
| D. | 除去乙酸乙酯中少量的乙酸:用氢氧化钠溶液洗涤,分液、干燥、蒸馏 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
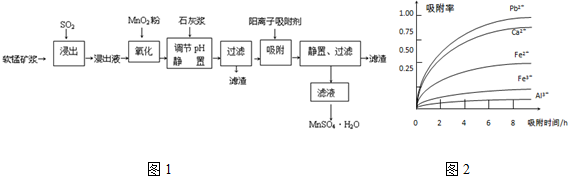
| 离子 | 离子半径(pm) | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 74 | 7.6 | 9.7 |
| Fe3+ | 64 | 2.7 | 3.7 |
| Al3+ | 50 | 3.8 | 4.7 |
| Mn2+ | 80 | 8.3 | 9.8 |
| Pb2+ | 121 | 8.0 | 8.8 |
| Ca2+ | 99 | - | - |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com