
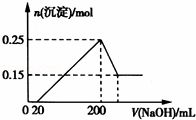
将一定质量的Mg和Al的混合物投入250mL、2.0mol/L稀硫酸中,固体全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.则下列说法正确的是( )
|
| A. | 当加入氢氧化钠溶液的体积为20 mL时,溶液的pH等于7 |
|
| B. | 当加入氢氧化钠溶液的体积为20 mL时,溶液中的溶质只有硫酸镁和硫酸铝 |
|
| C. | Na0H溶液的物质的量浓度为5 mol/L |
|
| D. | 生成的H2在标准状况下的体积为11.2 L |
| 有关混合物反应的计算.. | |
| 专题: | 计算题. |
| 分析: | 由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.25mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的倍.从200mL开始,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.25mol﹣0.15mol=0.1mol, A、铝离子水解,溶液呈酸性; B、由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O; C、沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)据此计算; D、由元素守恒可知n(Al)=n[Al(OH)3]=0.1mol,n(Mg)=n[Mg(OH)2]=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg),据此计算n(H2),再根据V=nVm计算氢气体积. |
| 解答: | 解:由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O.当V(NaOH溶液)=200mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,二者物质的量之和为0.25mol,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(Na2SO4)等于200mL氢氧化钠溶液中含有的n(NaOH)的倍.从200mL开始,NaOH溶解Al(OH)3:NaOH+Al(OH)3=NaAlO2+2H2O,当沉淀不再减少,此时全部为Mg(OH)2,物质的量为0.15mol,所以沉淀量最大时,Mg(OH)2为0.15mol,Al(OH)3为0.25mol﹣0.15mol=0.1mol, A、溶质有硫酸镁、硫酸铝和硫酸钠,铝离子水解,溶液呈酸性,故A错误; B、由图象可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中硫酸溶解Mg、Al后硫酸有剩余,此时发生的反应为:H2SO4+2NaOH=Na2SO4+2H2O,溶质有硫酸镁、硫酸铝和硫酸钠,故B错误; C、沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液中溶质为Na2SO4,根据钠元素守恒可知此时n(NaOH)=2n(Na2SO4)=2×0.25L×2mol/L=1mol,所以Na0H溶液的物质的量浓度为 D、由元素守恒可知n(Al)=n[Al(OH)3]=0.1mol,n(Mg)=n[Mg(OH)2]=0.15mol,根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg),根据电子转移守恒可知2n(H2)=3n(Al)+2n(Mg)=3×0.1mol+2×0.15mol=0.6mol,所以n(H2)=0.3mol,故氢气体积为0.3mol×22.4mol/L=6.72L,故D错误; 故选C. |
| 点评: | 本题考查镁铝的重要化合物、化学计算,以图象题的形式考查,题目难度中等,注意分析图象各阶段的物质的量的关系,根据各阶段的化学反应,利用守恒计算. |


科目:高中化学 来源: 题型:
安全是顺利进行实验的保障,下列实验处理或方法正确的是( )
A.尾气(主要含氯气)用澄清石灰水吸收较好
B.把氢气和氯气混合光照制氯化氢
C.导管口点燃一氧化碳时也要验纯
D.重金属盐有毒,如果不慎食入氯化钡,喝硫酸铜溶液即可
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验可行或叙述正确的是( )
①不能用闻气味的方法区分丝织品和棉织物
②蔗糖加稀硫酸的水解液,再加新制Cu(OH)2悬浊液共热会产生砖红色沉淀
③乙酸乙酯、油脂在碱性条件下水解均可制肥皂
④用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
⑤金属的冶炼都是置换反应
⑥漂白粉、玻璃、脂肪是混合物,水银、明矾、蔗糖是纯净物
⑦盐酸、BaSO4是强电解质,氨水是弱电解质,苯、四氯化碳是非电解质
⑧符合n(C):n(H)=n:(2n+2)的物质一定是烷烃
⑨煤中含苯及甲苯,可以用先干馏后分馏的方法把它们分离出来
⑩离子键只存在于离子化合物中,共价键只存在于共价化合物和离子化合物中.
|
| A. | ⑤⑥⑧⑨⑩ | B. | ①⑥ | C. | ①⑤⑥⑨⑩ | D. | ②③⑦⑨ |
查看答案和解析>>
科目:高中化学 来源: 题型:
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物质的量浓度分别是4mol/L和2mol/L,取10mL此混合酸,向其中加入过量的铁粉,待反应结束后,可产生标准状况下的混合气体体积为(设反应中HNO3被还原成NO)( )
|
| A. | 0.448L | B. | 0.672L | C. | 0.896L | D. | 0.224L |
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑可用于地下水脱氮,实验室研究步骤如下:
Ⅰ、将铁屑浸泡在0.5mol/L盐酸中进行预处理.
Ⅱ、30min后,用去离子水反复冲洗,至冲洗后液体的pH为中性.在N2保护下烘干备用.
Ⅲ、在蒸馏水中加入硝酸钾配制硝酸钾溶液.
Ⅳ、将酸预处理后的铁屑加入硝酸钾溶液中.
请回答:
(1)盐酸溶解Fe2O3的离子方程式是 .
(2)烘干时需要在N2保护下进行的原因是 .
(3)将步骤Ⅱ中冲洗后的溶液在空气中加热蒸发灼烧,最终得到的固体是 .
(4)将酸性条件下,铁与NO3﹣反应的离子方程式补充完整:
Fe+ NO3﹣+ + ═ Fe2++ NH4++ .
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置检验乙烯时不需要除杂的是( )
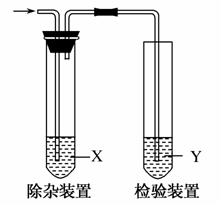
| 乙烯的制备 | 试剂X | 试剂Y | |
| A | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
| B | CH3CH2Br与NaOH乙醇溶液共热 | H2O | Br2的CCl4溶液 |
| C | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | KMnO4酸性溶液 |
| D | C2H5OH与浓H2SO4加热至170℃ | NaOH溶液 | Br2的CCl4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中正确的是
A.Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质
B.蔗糖、油脂及它们的水解产物均为非电解质
C.海水提取溴、煤的液化、焰色反应都发生了化学变化
D.钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高
查看答案和解析>>
科目:高中化学 来源: 题型:
按以下装置图进行实验,填写有关现象及化学方程式
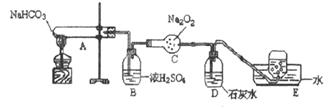
①A中现象是____________________
②B中浓硫酸的作用是____________________
③C中发生反应的化学方程式为____________________
④D中现象是____________________,反应的离子方程式是______________
⑤E中收集的气体是____________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com