
 现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:
现用0.02500mol/L的标准盐酸溶液滴定某未知浓度的氢氧化钠溶液,有关数据记录如表:| 序号 | 待测液体积(ml) | 所消耗标准盐酸的体积(ml) | ||
| 滴定前 | 滴定后 | 消耗体积 | ||
| 1 | 25.00 | 1.00 | 27.30 | 26.30 |
| 2 | 25.00 | ? | ? | ? |
| 3 | 25.00 | 1.50 | 27.84 | 26.34 |
分析 (1)用盐酸滴定氢氧化钠溶液,可以选择酚酞作指示剂;酸性溶液用酸式滴定管盛放,待测溶液盛放在锥形瓶中;滴定时,目光观察溶液颜色的变化,根据颜色变化判断滴定终点;
(2)根据数据的有效性,舍去第2组数据,然后求出1、3组平均消耗V(盐酸),带入c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$求算;
(3)根据错误操作对标准溶液的体积的影响,结合c(待测)=$\frac{c(标准)×V(标准)}{V(待测)}$分析.
解答 解:(1)用盐酸滴定氢氧化钠溶液,可以选择酚酞作指示剂,不能用石蕊,石蕊的变色范围太大;标准盐酸溶液应该用酸式滴定管盛放,待测溶液氢氧化钠盛放在锥形瓶中;滴定时,目光观察锥形瓶中溶液颜色的变化,酚酞在氢氧化钠溶液中显红色,当滴加最后一滴盐酸时溶液由浅红色变为无色,并且半分钟内不恢复红色;
故答案为:酚酞;当滴加最后一滴盐酸时溶液由浅红色变为无色,并且半分钟内不恢复红色;
(2)由图表示第二组实验时滴定前后滴定管中的液面位置,可知该次所用标准盐酸的体积为24.50mL,三次消耗的盐酸的体积分别为 26.30ml,24.50mL,26.34ml,第二次数据误差过大,应该舍去;另外两次的平均值为 $\frac{26.30mL+26.34mL}{2}$=26.32ml,
c(待测)=$\frac{0.025×0.02632}{0.025}$=0.02632mol/L;
故答案为:0.02632mol/L;
(3)①滴定时酸式滴定管用蒸馏水洗涤后未用标准液润洗,标准溶液的浓度减小,滴定消耗的标准溶液的体积偏大,则c(待测)偏大;
故答案为:偏大;
②滴定过程中,不小心将锥形瓶内液体摇到瓶外,待测溶液中溶质的物质的量偏小,消耗的标准溶液的体积偏小,则c(待测)偏小;
故答案为:偏小;
③锥形瓶用蒸馏水洗涤后为干燥直接装待测液,对滴定结果无影响;
故答案为:无影响;
④量取待测液时,刚开始尖嘴处有气泡后来消失,则待测溶液的体积偏小,耗的标准溶液的体积偏小,则c(待测)偏小;
故答案为:偏小;
⑤滴定前平视读数,滴定后仰视读数,则读数偏大,即消耗的标准溶液的体积偏大,则c(待测)偏大;
故答案为:偏大.
点评 本题考查了滴定操作和计算,题目难度中等,操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响.


科目:高中化学 来源: 题型:解答题
 氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
氯化硫酰(SO2Cl2)主要用作氯化剂.它是一种无色液体,熔点-54.1℃,沸点69.1℃.氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
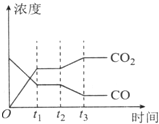 节能减排是当下环境保护的重点.
节能减排是当下环境保护的重点.| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| 容器编号 | c(CO)/mol•L-1 | c(02)/mol•L-1 | c(C02)/mol•L-1 | V(正)和v(逆)比较 |
| Ⅰ | 2.0×10-4 | 4.0×10-4 | 4.0×10-2 | V(正)=v(逆 |
| Ⅱ | 3.0×10-4 | 4.0×10-4 | 5.0×10-2 | V(正)> v(逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,3.01×1023个CCl4所占的体积约为11.2 L | |
| B. | 80 g NH4NO3晶体中约含有NH4+ 6.02×1023个 | |
| C. | 3.9 gNa2O2吸收足量的CO2时转移的电子数约是3.01×1022 | |
| D. | 46 g NO2和N2O4混合气体中含有原子数约为1.806×1024 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 天然气为纯净物 | |
| B. | 天然气是不可再生的能源 | |
| C. | 乙烯的结构简式为CH2CH2 | |
| D. | 过量的CH4和Cl2在光照条件下反应只生成CH3Cl和HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯是无色带有特殊气味的液体 | |
| B. | 常温下苯是一种不溶于水且密度小于水的液体 | |
| C. | 苯在一定条件下能与溴发生取代反应 | |
| D. | 苯不具有典型的双键所应具有的发生加成反应的特性,故不可能发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com