
分析 (1)根据Fe、Fe3O4能被磁铁吸附来回答;
(2)①四氧化三铁可以和盐酸反应,铁离子遇到硫氰化钾显示血红色;
②金属铁可以和铁离子之间发生反应生成亚铁离子;
(3)黑色粉末加入过量盐酸溶解后,加入足量氨水沉淀离子,加入足量氢氧化钠保证碱性环境下离子全部沉淀,操作Ⅱ是过滤、洗涤得到沉淀,放在坩埚内灼烧制恒重得到红褐色固体为氧化铁;依据反应的化学方程式,结合铁元素守恒计算判断;
(4)亚铁离子易被氧气氧化为三价铁,FeCO3与氧气、水反应生成氢氧化铁和二氧化碳.
解答 解:(1)黑色粉末能被磁铁吸附,Fe、Fe3O4能被磁铁吸附,故不能由此确定X就是铁单质,
故答案为:Fe3O4也能被磁铁吸咐,故不能由此确定X就是铁单质;
(2)①滴加几滴KSCN溶液,溶液出现血红色,可以证明存在Fe3+,进而证明黑色固体中含有四氧化三铁,确认Fe3O4的存在,
故答案为:检验是否存在Fe3+,确认Fe3O4的存在;
②X的组成是Fe和Fe3O4,向其中加入盐酸,Fe3O4溶于其中得到氯化铁溶液会和金属铁之间反应得到氯化亚铁,即Fe+2Fe3+=3Fe2+,不会使KSCN变色,
故答案为:Fe+2Fe3+=3Fe2+;
(3)①流程是黑色粉末加入过量盐酸溶解后,加入足量氨水沉淀离子,加入足量氢氧化钠保证碱性环境下离子全部沉淀,操作Ⅱ是过滤、洗涤得到沉淀,
故答案为:过滤、洗涤;
②2.88gX$→_{搅拌}^{足量盐酸}$溶液Y$→_{足量氨水}^{足量H_{2}O_{2}操作Z}$沉淀$\stackrel{烧灼}{→}$3.2g红棕色固体
依据反应过程中铁元素守恒,3.2gFe2O3物质的量=$\frac{3.2g}{160g/mol}$=0.02mol;设铁物质的量为X,四氧化三铁物质的量为Y,得到:56X+232Y=2.88,X+3Y=0.02×2,解方程得到X=0.01mol;Y=0.01mol;
即n(Fe3O4)=0.01mol;n(Fe)=0.01mol.
故答案为:n(Fe3O4)=0.01mol、n(Fe)=0.01mol.
(4)碳酸亚铁中,亚铁离子易被氧气氧化为三价铁,FeCO3与氧气、水反应生成氢氧化铁和二氧化碳,反应的化学方程式为:4FeCO3+O2+6H2O=4CO2+4Fe(OH)3,
故答案为:4FeCO3+O2+6H2O=4Fe(OH)3+4CO2.
点评 本题考查了探究物质组成,测定物质含量的定量实验操作和实验设计,主要考查铁及其化合物的性质应用,实验基本操作的分析判断,实验现象的推断和应用,元素守恒的计算应用,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积 V(mL) |
| 1 | 22.4 | 10.00 |
| 2 | 22.60 | 10.00 |
| 3 | 26.00 | 10.00 |
| 4 | 22.50 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
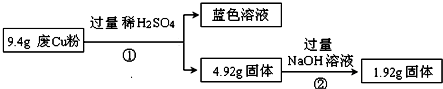

| 电解质 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时的pH | 5.4 | 6.5 | 3.5 |
| 完全沉淀时的pH | 6.4 | 9.6 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
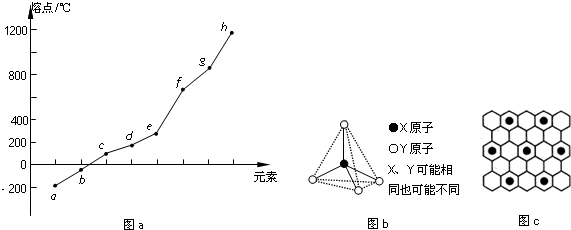
| 氢化物 | A | B | HF | D | E |
| 沸点/℃ | 1317 | 100 | 19.5 | -33.35 | -164 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
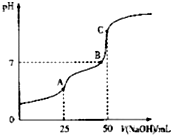 25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )
25°C时,向25ml 0.1wol•L-1 H2C2O4溶液中滴加同浓度的NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化如图所示.下列有关叙述错误的是( )| A. | HC2O4-的电离程度大于其水解程度 | |
| B. | B点时溶液中含有NaHC2O4和Na2C2O4 | |
| C. | A点时,c(Na+)+c(H+)=c(OH-)+c(HC2O4-)+2c(C2O42-) | |
| D. | C点时,c(Na+)>c(C2O42-)>c(HC2O4-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用磁铁可以将Fe与Fe3O4分离 | |
| B. | 将生成的气体在空气中冷却可获得钠 | |
| C. | 该反应条件下铁的氧化性比钠强 | |
| D. | 每生成1molH2,转移的电子数约为4×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com