
����Ŀ��Ԫ����~�������ڱ��е�λ�������ʾ���Իش��������⡣
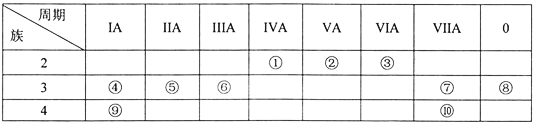
��1������10��Ԫ���У���ѧ��������õ���___(��Ԫ�ط��ţ���ͬ)����ˮ��Ӧ��ҵĽ���Ԫ����___________��
��2��Ԫ��������̬�⻯��ķ���ʽ��_____������10��Ԫ���У�������������Ӧˮ�����������ǿ��������_______(�ѧʽ)��
��3��Ԫ���������γɵij������������Ļ�����ĵ���ʽ_________��
��4���٢ڢ�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ______(��Ԫ�ط��ű�ʾ)��
����һ����ѧ����ʽ(�����ӷ���ʽ)˵��Ԫ���������ǽ����Ե�ǿ����_____��
��5����������Ԫ�ص�����������Ӧ��ˮ�������Ӧ�����ӷ���ʽ��____________��
���𰸡� Ar K NH3 HClO4 ![]() N<C<Mg 2HBr+Cl2=2HC1+Br2 Al(OH)3+OH-=AlO2-+2H2O
N<C<Mg 2HBr+Cl2=2HC1+Br2 Al(OH)3+OH-=AlO2-+2H2O
��������Ԫ����~�������ڱ��е�λ�������ʾ,��ΪC,��ΪN,��ΪO,��ΪNa,��ΪMg,��ΪAl,��ΪCl,��ΪAr,��ΪK,��ΪBr��
(1)0��Ԫ�ػ�ѧ�����ȶ�,����10��Ԫ����,��ѧ��������õ���Ar��������ǿ����ˮ��Ӧ������ͬ���ڽ����Լ�����ͬ�����������ǿ������ˮ��Ӧ��ҵĽ���Ԫ����K����ȷ����Ar�� K��
(2)Ԫ��������̬�⻯��Ϊ����,����ʽ��NH3 ,�ǽ�������ǿ�ķǽ����γ�����������Ӧˮ�����������ǿ��ͬ���ڴ����ҷǽ�������ǿ��ͬ������ϵ��·ǽ����Լ���������10��Ԫ����������������Ӧˮ�����������ǿ��������HClO4 ����ȷ��: NH3��HClO4��
(3) Ԫ�آ�����γɵij������������Ļ�����Ϊ�������ƣ�Ϊ���ӻ���������ʽ��![]() ����ȷ�𰸣�
����ȷ�𰸣�![]() ��
��
��4��ԭ�Ӱ뾶�Ƚ��ǵ��Ӳ���Խ��뾶Խ��,���Ӳ�����ͬ,�˵����Խ��뾶ԽС,�٢ڢ�Ԫ�ص�ԭ�Ӱ뾶��С�����˳��Ϊ:N��C��Mg��ͬһ���������ϵ������ǽ����Լ�������˷ǽ�����Cl> Br�����ʵ���������Cl2> Br2�����������û��嵥�������ԴﵽĿ����������ͨ�뵽��������Һ�������ɵ���������ѧ����ʽΪ2HBr+Cl2=2HC1+Br2����ȷ�𰸣�N<C<Mg �� 2HBr+Cl2=2HC1+Br2��
��5����Ԫ�ص�����������Ӧ��ˮ����ΪNaOH����Ԫ���γɵ�����������Ӧ��ˮ����Ϊ����������������������������������������Һ����ƫ�����ƺ�ˮ����Ӧ�����ӷ���ʽΪ: Al(OH)3+OH-=AlO2-+2H2O����ȷ����Al(OH)3+OH-=AlO2-+2H2O��


 ������ĩ��ϰ��ѵ��ϵ�д�
������ĩ��ϰ��ѵ��ϵ�д� С��ʿ��ĩ����100��ϵ�д�
С��ʿ��ĩ����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��CO2��������ɺϳ���ϩ��2CO2(g)+6H2(g ) ![]() C2H4(g)+4H2O(g)��0.1Mpaʱ����n(CO2):n(H2)=1:3Ͷ�ϣ���ò�ͬ�¶���ƽ��ʱ��ϵ�и�����Ũ�ȵĹ�ϵ��ͼ��������������ȷ���ǣ� ��
C2H4(g)+4H2O(g)��0.1Mpaʱ����n(CO2):n(H2)=1:3Ͷ�ϣ���ò�ͬ�¶���ƽ��ʱ��ϵ�и�����Ũ�ȵĹ�ϵ��ͼ��������������ȷ���ǣ� ��

A. �÷�Ӧ�Ħ�H<0
B. ����b����H2O
C. N���M��������״̬c(H2)��һ��
D. �����������䣬T1����0.2MPa�·�Ӧ��ƽ��ʱc(H2)��M���
���𰸡�C
���������¶����ߣ�H2��Ũ������ƽ�����ƣ����������ȣ�������ȣ���H<0��������aΪCO2�����ݷ���ʽ�ı�����ϵ����֪����bΪH2O, ����cΪC2H4����A��ȷ��B��ȷ��C�N���M�����������ͬһT1���£�������״̬��c(H2)��һ���ģ�D���� �����������䣬T1����0.2 MPa���0.1 MPa��������ѹǿ�������С��c(H2)�������·�Ӧ��ƽ��ʱc(H2)��M�����D����ȷ��
�����͡���ѡ��
��������
12
����Ŀ���ݱ������ҹ������Ƴ����ɳ�������-������̼��ء����缫����Ϊ�ƽ���Ƭ��̼���ܣ����ҺΪ��������-�ĸʴ������ѣ�����ܷ�ӦΪ��4Na+3CO2![]() 2Na2CO3+C�����ɹ���Na2CO3������̼�����ϡ�������������ȷ���ǣ� ��
2Na2CO3+C�����ɹ���Na2CO3������̼�����ϡ�������������ȷ���ǣ� ��
A. �ŵ�ʱ�ƽ���Ƭ����������Ӧ
B. ���ʱ̼���ܽ�ֱ����Դ������
C. �ŵ�ʱÿ����3mol CO2��ת��12mol����
D. ���ʱ��������ӦΪC+2Na2CO3��4e-===3CO2��+4Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ںϽ��˵����������� �� ��
A.�Ͻ��Ӳ�ȴ���������Ĵ�������Ӳ��B.�Ͻ����ڴ�����
C.�Ͻ���۵����������Ĵ��������۵�D.�Ͻ����ڻ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�о�С���Դ��κ�̼����泥�NH4HCO3��Ϊԭ�ϣ��������������Ʊ�������Ȼ�泥� ��֪�ε��ȷֽ��¶ȣ�NH4HCO3 36�棻 NaHCO3 270�棻 NH4Cl 340�棻 Na2CO3��850��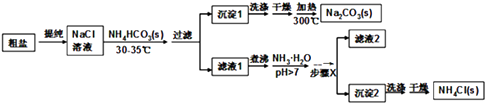
��1�������к���Ca2+��Mg2+��SO42�����������ӣ�ʹ�õ��Լ��У���NaOH ��BaCl2��HCl ��Na2CO3 �� ������˳��������� A���٢ۢܢ�B���٢ڢܢ�C���ۢڢܢ�D���٢ڢۢ�
�������õ�����������������
��2������жϴ�����SO42���Ƿ��ѳ�������
��3����NaCl��Һ������1�Ĺ����У�������Ũ�����ڼ������NH4HCO3֮ǰ��������Ũ�������ڼ���NH4HCO3֮��ԭ������
��4��д������1���ȷֽ�Ļ�ѧ����ʽ��
��5��Ϊ���NH4Cl��Ʒ�IJ��ʺʹ��ȣ�������Һ�м��백ˮ��������������X�����IJ�������
��6�����á���ȩ�����ⶨ��ҵ��Ʒ���Ȼ�淋Ĵ��ȣ��ٶ����ʲ����ȩ��Ӧ������Ӧԭ��Ϊ��4NH4Cl+6HCHO����CH2��6N4+4HCl+6H2O ij������Ա��ȡ1.5g����Ʒ����ˮ�����������ļ�ȩ����ˮ���100mL��Һ������ȡ��10mL�������̪����0.1mol/L��NaOH��Һ�ζ������ζ��յ�ʱ����NaOH��Һ25.00mL�������Ʒ���Ȼ�淋���������Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾij���л���Ľṹ����������������������ȷ������ ��
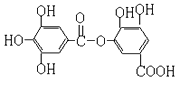
A. 1mol���л�����һ�������£�����7molH2�����ӳɷ�Ӧ
B. ������FeCl3��Һ���÷�����ɫ��Ӧ
C. ����NaHCO3��Ӧ�ų�����
D. 1mol���л�����һ�������£�����7molNaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Σ�ջ�ѧƷҪ�ڰ�װ��ǩ��ӡ�о�ʾ�Ա�־�����л�ѧҩƷ�����뾯ʾ��־���ƶ�Ӧ��ȷ���ǣ� ��
A.Ũ����������ʴƷB.�ƾ������綾Ʒ
C.����������ըƷD.�ռ������綾Ʒ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£�������ijһ��Ӧ��M��N�����ʵ����淴Ӧʱ��仯��������ͼ�����б�������ȷ���ǣ� �� 
A.��Ӧ�Ļ�ѧ����ʽΪ��2MN
B.t2ʱ�����淴Ӧ������ȣ��ﵽƽ��
C.t3ʱ������Ӧ���ʴ����淴Ӧ����
D.t1ʱ��N��Ũ����MŨ�ȵ�2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��¡��ݻ�Ϊ2L���ܱ�������ͨ��1molN2��xmolH2�������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)������5min�ﵽƽ��ʱ�������������ʵ���Ϊ3.6mol�������ڵ�ѹǿ��Ϊԭ����90%���Իش�(����д��Ҫ�ļ��㲽��)��
2NH3(g)������5min�ﵽƽ��ʱ�������������ʵ���Ϊ3.6mol�������ڵ�ѹǿ��Ϊԭ����90%���Իش�(����д��Ҫ�ļ��㲽��)��
��1����ʼʱ����H2�����ʵ���_________��
��2��ƽ��ʱN2��Ũ��_______��
��3��5min����NH3��ʾ�Ļ�ѧ��Ӧ����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ�������´��ڷ�Ӧ��CO(g)��H2O(g) ![]() CO2(g)��H2(g)����H����Q kJ/mol(Q>0)������������ͬ��2 L���ݾ���(�����û����������)�ܱ����������������������г���1 mol CO��1 mol H2O�������г���1 mol CO2��1 mol H2�������г���2 mol CO��2 mol H2O��700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ�������������̶�Ӧ�������仯ֵ�ֱ�ΪQ1��Q2��Q3������˵����ȷ����
CO2(g)��H2(g)����H����Q kJ/mol(Q>0)������������ͬ��2 L���ݾ���(�����û����������)�ܱ����������������������г���1 mol CO��1 mol H2O�������г���1 mol CO2��1 mol H2�������г���2 mol CO��2 mol H2O��700 �������¿�ʼ��Ӧ���ﵽƽ��ʱ�������������̶�Ӧ�������仯ֵ�ֱ�ΪQ1��Q2��Q3������˵����ȷ����
A. 2Q1��2Q2��Q3
B. ��������CO�İٷֺ�������������CO�İٷֺ�����
C. �������з�Ӧ��ƽ�ⳣ�����������з�Ӧ��ƽ�ⳣ��С
D. ��������CO��ת��������������CO2��ת����֮�͵���1
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com