
| 滴定序号 | 待测液体积(ml) | 所消耗盐酸标准液的体积(ml) | |
| 滴定前 | 滴定后 | ||
| 1 | 20.00 | 0.50 | 20.70 |
| 2 | 20.00 | 6.00 | 26.00 |
分析 (1)根据操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作选取实验仪器;
(2)①酸性溶液应用酸式滴定管盛放;
②滴定时眼睛注视锥形瓶中颜色变化;如溶液颜色变化且半分钟内不变色,可说明达到滴定终点;
(3)先分析数据的有效性,求出消耗盐酸的平均体积,然后根据关系式NaOH~HCl求出氢氧化钠的物质的量浓度,再计算烧碱样品的纯度;
(4)①用蒸馏水冲洗锥形瓶待测液溶质物质的量不变;
②滴定过程中不慎将数滴酸液滴在锥形瓶外,消耗标准溶液体积偏大;
③指示剂局部的颜色有变化就停止滴定,反应没有结束,消耗的标准液体积偏小;
④滴定前仰视,导致读数偏大;滴定后俯视,导致读数偏小,导致标准液体积偏小.
解答 解:(1)操作步骤有称量、溶解、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),冷却后转移到1000ml容量瓶 容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器是天平、药匙、烧杯、量筒、玻璃棒、100ml容量瓶、胶头滴管;
故答案为:烧杯、玻璃棒、100mL容量瓶、量筒、胶头滴管;
(2)①盛装0.1000mol•L-1盐酸标准液应该使用酸式滴定管;
故答案为:酸;
②滴定时双眼应注意观察锥形瓶内溶液颜色的变化,和滴定速度以判定滴定终点;
滴定时,当溶液颜色由红色变为无色,且半分钟内不变色,可说明达到滴定终点;
故答案为:锥形瓶内溶液的颜色变化和滴定速度;C;
(3)两次消耗盐酸体积分别为:20.70mL-0.50mL=20.20mL、26.00mL-6.00mL=20.00mL,两消耗盐酸的平均体积为:20.10mL,
NaOH~HCl
1 1
n(NaOH) 0.2mol•L-1×0.0201L
n(NaOH)=0.00402mol,故c(NaOH)=$\frac{0.00402mol}{0.02L}$=0.201mol/L,即20.00mL待测溶液含有m(烧碱)=n•M=0.00402mol×40g/mol=0.1608g,
所以100mL待测溶液含有m(烧碱)=0.1608g×$\frac{100}{20}$=0.804g,
烧碱的纯度ω(烧碱)=$\frac{0.804g}{0.85g}$×100%=94.6%,
故答案为:0.201mol/L;94.6%;
(4)①若用蒸馏水冲洗锥形瓶,待测液溶质物质的量不变,消耗标准溶液体积不变,不影响测定的结果,
故答案为:无影响;
②滴定过程中不慎将数滴酸液滴在锥形瓶外,消耗标准溶液体积偏大,计算得到待测液浓度偏高,
故答案为:偏高;
③指示剂局部的颜色有变化就停止滴定,反应还没有结束,导致消耗的标准液体积偏小,测定结果偏低,
故答案为:偏低;
④滴定前仰视,导致标准液的体积读数偏大;滴定后俯视,导致标准液的体积的读数偏小,最终导致标标准液体积偏小,测定结果偏低;
故答案为:偏低.
点评 本题考查了溶液配制、滴定操作,操作时要规范,分析误差时要看是否影响标准体积的用量,若标准体积偏大,结果偏高;若标准体积偏小,则结果偏小;若不影响标准体积,则结果无影响,题目难度中等.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验内容 | 实验目的 |
| A | 用注射器收集铜与浓硝酸反应生成的气体,然后推拉注射器 | 研究压强对化学平衡移动的影响 |
| B | 在实验室制得的乙酸乙酯中加入饱和碳酸钠溶液,然后蒸馏 | 除去乙酸乙酯中混有的乙酸、乙醇 |
| C | 用饱和FeCl3溶液制得Fe(OH)3胶体,然后过滤 | 提纯Fe (OH)3胶体 |
| D | 往混有FeCl2的CuCl2溶液中加人H2O2后,用氨水调节pH 至2.7 后过滤 | 除去CuCl2溶液中FeCl2杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
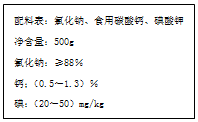 如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:
如图是某厂生产的某种加钙食盐包装标签上的部分文字,请阅读后回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
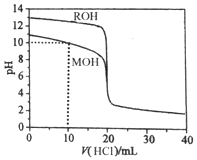
| A. | pH=10时,c(M+)>c(MOH)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 将上述MOH、ROH溶液等体积混合后,用盐酸滴定至MOH恰好反应时:c(R+)>c(M+)>c(H+)>c(OH-) | |
| C. | 10mL<V(HCl)<20mL时,c(M+)+c(MOH)<c(Cl-) | |
| D. | V(HCl)>20mL时,不可能存在:c(Cl-)>c(M+)=c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
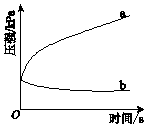 生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )
生铁在pH=2和pH=4的盐酸中发生腐蚀.在密闭容器中,用压强传感器记录该过程的压强变化,如图所示.下列说法中,不正确的是( )| A. | 两容器中负极反应均为Fe-2e-═Fe2+ | |
| B. | 曲线a记录的是pH=2的盐酸中压强的变化 | |
| C. | 曲线b记录的容器中正极反应是O2+4e-+2H2O═4OH- | |
| D. | 在弱酸性溶液中,生铁能发生吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 古代染坊常用某种“碱剂”来促进丝绸表层的丝胶蛋白杂质水解而除去,该“碱剂”,的主要成分是一种盐.这种“碱剂”可能是草木灰 | |
| B. | 生活中常用的塑料制品、橡胶制品为离分子材料,钢化玻璃、有机玻璃是硅酸盐材料 | |
| C. | 铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单 | |
| D. | 聚乙炔经处理后可形成一种导电塑料,该塑料是一种纯净物,有固定的熔点、沸点 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com