
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:
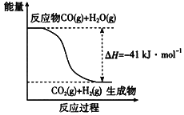
反应的热化学方程式为____________________________________________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,则![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g) ΔH=______________。
NH3(g) ΔH=______________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:①C(s,石墨)+O2(g)![]() CO2(g) ΔH1=-393.5kJ·mol-1
CO2(g) ΔH1=-393.5kJ·mol-1
②2H2(g)+O2(g)![]() 2H2O(l) ΔH2=-571.6kJ·mol-1
2H2O(l) ΔH2=-571.6kJ·mol-1
③2C2H2(g)+5O2(g)![]() 4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
4CO2(g)+2H2O(l) ΔH3=-2599kJ·mol-1
298K时反应2C(s,石墨)+H2(g)![]() C2H2(g)的焓变:ΔH=_______________。
C2H2(g)的焓变:ΔH=_______________。
(4)已知:铝热反应是放热反应,又知,常温下:
4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1
2Al2O3(s) ΔH1
4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH2
2Fe2O3(s) ΔH2
下面关于ΔH1、ΔH2的比较正确的是________
A.ΔH1>ΔH2 B.ΔH1<ΔH2 C.ΔH1=ΔH2 D.无法计算
【答案】CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1226.7kJ·mol-1 B
CO2(g)+H2(g) ΔH=-41kJ·mol-1-46.2kJ·mol-1226.7kJ·mol-1 B
【解析】
(1)依据图象分析反应物能量高于生成物能量,反应是放热反应,书写热化学方程式时,注意标注物质聚集状态和对应焓变的大小;(2)△H=反应物的键能-生成物的键能;(3)将已知三个热化学方程式依次编号为①②③,由盖斯定律可知目标热化学方程式等于①×2+②×![]() -③×
-③×![]() ;(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s) △H=△H1-△H2。
;(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s) △H=△H1-△H2。
(1)由图象可知,反应物能量高于生成物能量,该反应是放热反应,1molCO完全反应放出的热量41kJ,热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41 kJ/mol。(2)据题意,N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1,N-H键的键能是391.55kJ·mol-1,由△H=反应物的键能-生成物的键能可知,0.5mol氮气和1.5mol氢气反应生成1mol氨气时△H=(3×391.55kJ·mol-1)—(0.5×948.9kJ·mol-1+1.5×436.0kJ·mol-1)=46.2 kJ·mol-1。(3)目标反应为2C(s,石墨)+H2(g)= C2H2(g),将已知三个热化学方程式依次编号为①②③,由盖斯定律可知目标热化学方程式等于①×2+②×![]() -③×
-③×![]() ,所以反应焓变△H=2×(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)×
,所以反应焓变△H=2×(-393.5 kJ·mol-1)+(-571.6 kJ·mol-1)×![]() -(-2599 kJ·mol-1)×
-(-2599 kJ·mol-1)×![]() =+226.7 kJ·mol-1。(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1-△H2,铝热反应为放热反应,即△H1-△H2<0,所以△H1<△H2,故选B。
=+226.7 kJ·mol-1。(4)将已知两个热化学方程式依次编号为①②,由盖斯定律,①-②可得:4Al(s)+2Fe2O3═2Al2O3(s)+4Fe(s)△H1-△H2,铝热反应为放热反应,即△H1-△H2<0,所以△H1<△H2,故选B。


科目:高中化学 来源: 题型:
【题目】下图是汽车尾气催化转化装置工作原理示意图:
![]()
![]()
![]()
![]()
![]()
下列说法不正确的是
A. 汽车尾气是雾霾成因之一,主要由CO、NO
B. 该过程中NO2既是生成物又是反应物
C. 整个过程中氧元素被还原,氮元素被氧化
D. 过程②中会有反应:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收,其中Y是单质。
SO 2(g) + 2CO(g)![]() 2X(g)+Y(l)
2X(g)+Y(l)
为了测定在某种催化剂作用下的反应速率,在某温度下用超灵敏气体传感器测得不同时间的SO2和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 |
c(SO2)/mol·L-1 | 1.00 | 0.50 | 0.23 | 3.00×10-37 | 3.00×10-37 |
c(CO)/mol·L-1 | 4.00 | 3.00 | 2.46 | 2.00 | 2.00 |
下列说法不正确的是
A. X的化学式为CO2
B. 前1s内v(X)=" 1.00" mol·L-1·s-1
C. 该回收原理运用了SO2的还原性
D. 该温度下,此反应的平衡常数的数值是3.33×1036
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是人类赖以生存和发展的重要物质基础,常规能源的合理利用和新能源的合理开发是当今社会面临的严峻课题,回答下列问题:
(1)我国是世界上少数以煤为主要燃料的国家,下列关于煤作燃料的论点正确的是 ___________________(填字母)。
A.煤是重要的化工原料,把煤作燃料简单燃烧掉太可惜,应该综合利用
B.煤是发热量很高的固体燃料,我国煤炭资源相对集中,开采成本低,用煤作燃料实惠
C.煤燃烧时产生大量二氧化硫和烟尘,对环境污染严重
D.通过洁净煤技术,如煤的气化和液化,以及烟气脱硫,不仅减轻了燃煤污染,还能提高煤燃烧的热利用率
(2)乙醇是未来内燃机的首选环保型液体燃料。2.0 g乙醇完全燃烧生成液态水放出59.43 kJ的热量,则乙醇燃烧的热化学方程式为____________________________________________________________。
(3)由于C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJmol1(b>0)的反应中,反应物具有的总能量________(填“大于”“等于”或“小于”)生成物具有的总能量,那么在化学反应时,反应物就需要________(填“放出”或“吸收”)能量才能转化为生成物。
(4)关于用水制取二次能源氢气,以下研究方向不正确的是________________
A.组成水的氢和氧都是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二次能源
B.设法将太阳光聚焦,产生高温,使水分解产生氢气
C.寻找高效催化剂,使水分解产生氢气,同时释放能量
D.寻找特殊催化剂,用于开发廉价能源,以分解水制取氢气
(5)已知下列两个热化学方程式:
A、2H2(g)+O2(g) ===2H2O(l) △H=-571.6 kJmol-1 B、C3H8(g)+5O2(g) ===3CO2(g)+4 H2O(l) △H=-2 220 kJmol-1,其中,能表示燃烧热的热化学方程式为___________(A或B),其燃烧热为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10 mL 0.1 mol·L-1 NH4HSO4溶液中逐滴滴入0.1 mol·L-1 NaOH溶液,溶液的pH与NaOH溶液体积关系如右图所示:
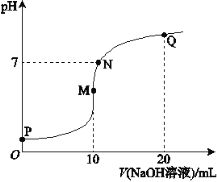
(1)用电离方程式表示P点pH<7的原因是________。
(2)M、Q两点中,水的电离程度较大的是________点。
(3)下列关系中,正确的是________。
a.M点c(Na+)>c(NH4+)
b.N点c(NH4+)+c(Na+)=2c(SO42-)
c.Q点c(NH4+)+c(NH3·H2O)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在杠杆的两端分别挂着质量、体积都相同的铝球和铁球,此时杠杆平衡.然后将两球分别浸没在稀硫酸和硫酸铜溶液中片刻,如图所示,则下列说法正确的是( )
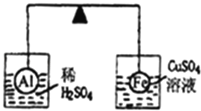
A.铝球一定是空心的
B.左边烧杯中的溶液质量减少了
C.去掉两烧杯杠杆仍平衡
D.右边铁球上出现红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1molX气体amolY气体在体积可变的密闭容器中发生如下反应:X(g)+aY(g)![]() bZ(g)反应一段时间后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,如果分别用Y和Z浓度的变化量计算该化学反应在这段时间内的化学反应速率,两者之比可能是( )
bZ(g)反应一段时间后,测得X的转化率为50%。而且,在同温同压下还测得反应前混合气体的密度是反应后混合气体密度的3/4,如果分别用Y和Z浓度的变化量计算该化学反应在这段时间内的化学反应速率,两者之比可能是( )
A. 3:1B. 2:1C. 1:2D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )

A. 反应②为氧化反应,反应现象是火焰明亮并带有较多的浓烟
B. 反应③为取代反应,有机产物是一种烃
C. 反应①为取代反应,有机产物的密度比水小
D. 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳碳双键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com