
某硫酸厂以含有SO2的尾气、氨水等为原料,合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
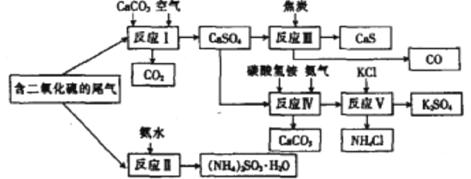
(1)写出反应Ⅲ的化学方程式:
(2)下列有关说法正确的是 (填字母)。
A反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅱ和反应Ⅲ的基本反应类型相同
C.反应Ⅳ需控制在60-70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
(3) (NH4 )2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式: .
(4)很多硫酸厂为回收利用SO2,直接用氨水吸收法处理尾气.
①用15. 0mL 2.0mol·L-1氨水吸收标准状况下448 mL SO2,吸收液中的溶质为
②某同学用酸性KMnO4溶液滴定上述吸收液,当达到滴定终点时,消耗KMnO4溶液25. 00 mL,则酸性KMnO4溶液中,c(KMnO4)=
(5)氨气用途广泛,可以直接用于燃料电池,右图是用氨水作燃料的燃料电池的工作原理。
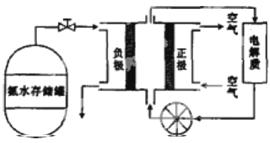
氨气燃料电池的电解质溶液最好选择 (填“酸性”“碱性”或“中性”)溶液,氮气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式
是_______________________________,负极的电极反应式是_______________________________
【知识点】二氧化硫的性质及物质的制备 化学电源 D3 F3
【答案解析】(1)CaSO4+4C 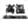 CaS+4CO
CaS+4CO (2分)
(2分)
(2)ACD(2分)
(3)4(NH4)2SO3+2NO2=4(NH4)2SO4+ N2(2分)
(4)①(NH4)2SO3、NH4H SO3
②0.32mol·L-1(各2分)
(5)碱性(1分);4NH3+3 O2=2N2+6H2O(2分);2NH3-6e-+6OH-= N2+6H2O(2分)
解析:(1)碳酸钙、二氧化硫和氧气反应生成硫酸钙和二氧化碳,方程式为2CaCO3+2SO2+O2═2CaSO4+2CO2
(2)A.过量的空气把亚硫酸钙氧化为硫酸钙,故正确;
B.反应Ⅲ化学方程式为:CaSO4+4C=CaS+4CO↑,是氧化还原反应,反应Ⅱ是非氧化还原反应,故错误;
C.防止碳酸氢铵在温度过高时分解得不到需要的目标产物,故正确;
D、氯化铵含N元素,是一种氮肥,故正确;
(3)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统,二氧化氮与亚硫酸铵反应,二氧化氮具有强氧化性能氧化亚硫酸铵,反应生成硫酸铵,本身被还原为氮气,由原子守恒可知化学方程式为4(NH4)2SO3+2NO2=4(NH4)2SO4+N2,
(4)①15. 0mL 2.0mol·L-1氨水的物质的量为0.03mol,吸收标准状况下448 mL SO2,SO2的物质的量为0.02mol,发生反应的方程式为:
3NH3.H2O+2SO2=(NH4)2SO3+NH4H SO3+H2O。
②根据上面的方程式知所得溶液中(NH4)2SO3和NH4H SO3物质的量和为0.02mol,与KMnO4溶液转移电子相等:0.02×2=0.025×c(KMnO4)×5,解得c(KMnO4)=0.32mol·L-1。
(5)氨气燃料电池的电解质溶液最好选择碱性溶液,氮气燃料电池的反应是氨气与氧气生成一种常见的无毒气体和水,该电池总反应的化学方程式:4NH3+3 O2=2N2+6H2O,
负极发生失电子的氧化反应反应:2NH3-6e-+6OH-= N2+6H2O
【思路点拨】本题考查了二氧化硫的性质及物质的制备,把握题中的信息及发生的反应为解答的关键,侧重二氧化硫的还原性及学生分析能力的考查,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
功能性纳米小分子的合成与功能研究是目前有机化学研究的热点问题。
(1)某分子记忆元件的结构简式为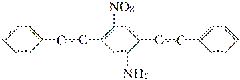 ,则它的分子式为______________,分子中所含的官能团有____________(只写两种)。
,则它的分子式为______________,分子中所含的官能团有____________(只写两种)。
(2)环蕃A(cyclophane)和超蕃B(superphane)是一种光电信息材料,都属于烃(B中氢原子未画出),它们的结构如图所示。
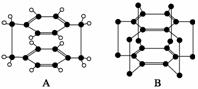
下列有关说法正确的是________。
A.环蕃和超蕃互为同系物
B.环蕃能使酸性高锰酸钾溶液褪色
C.环蕃能与液溴、硝酸发生取代反应
D.超蕃的一氯取代物只有1种,二氯取代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
流动电池是一种新型电池。其主要特点是可以通过电解质溶液的循环流动,在电池外部调节电解质溶液,以保持电池内部电极周围溶液浓度的稳定。北京化工大学新开发的一种流动电池如图所示,电池总反应为Cu+PbO2+2H2SO4=CuSO4+PbSO4+2H2O。下列说法不正确的是
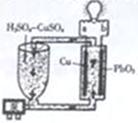
A.a为负极,b为正极 B.该电池工作时PbO2电极附近溶液的pH增大
C.a极的电极反应为Cu-2e-=Cu2+ D.调节电解质溶液的方法是补充CuSO4
查看答案和解析>>
科目:高中化学 来源: 题型:
工业合成氨与制备硝酸一般可连续生产,流程如图所示:
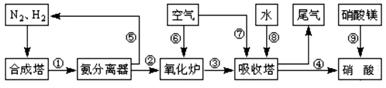
(1)工业生产时,制取氢气的一个反应为:CO+H2O(g) CO2+H2
CO2+H2
T℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
(2)合成塔中发生反应N2(g)+3H2(g) 2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
2NH3(g);△H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____573K(填“>”、“<”或“=”)。
| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
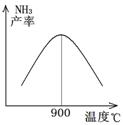
(3)N2和H2以铁作催化剂从145℃就开始反应,不同温度下NH3的产率如图所示。温度高于900℃时,NH3产率下降的原因是
(4)硝酸厂的尾气直接排放将污染空气,目前科学家探索利用燃料气体中的甲烷等将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2=(g)=4NO(g)+CO2(g)+2H2O(g); △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g); △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为:
(5)氨气在纯氧中燃烧,生成一种单质和水。科学家利用此原理,设计成氨气-氧气燃料电池,则通入氨气的电极碱性条件下发生反应的电极反应式为
。
查看答案和解析>>
科目:高中化学 来源: 题型:
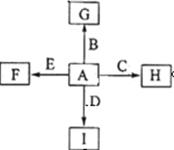
 如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
如图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,已知:
①反应C+G B+H能放出大量的热,G是红综色固体粉末;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.
2F+D,F中的E元素的质量分数为60%.
回答问题:
⑴ ①中反应的化学方程式为
(2) 1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,至少需要铜粉 克
(3) C与过量NaOH溶液反应的离子方程式为 ,
反应后的溶液与过量的化合物I反应的离子方程式为
(4) E与I反应的化学方程式为
(5) 写出H物质在工业上的一种用途_____________。
(6)将一定量的B完全溶于过量盐酸中,然后通入0.005mol Cl2,再加入0.01mol重铬酸钾晶体(K2Cr2O7),恰好使溶液中B2+全部转化为B3+,铬元素本身被还原为+3价铬离子。通过计算确定原B的物质的量为( )
A.0.01mol B.0.03mol C.0.04mol D.0.07mol
查看答案和解析>>
科目:高中化学 来源: 题型:
向明矾溶液里滴加Ba(OH)2溶液,当SO42-离子恰好沉淀完全时,铝元素的存在形式是
A.一部分为Al(OH)3沉淀,一部分以Al3+存在于溶液中
B.一部分为Al(OH)3沉淀,一部分以AlO2-形式存在于溶液中
C.全部为Al(OH)3沉淀
D.几乎全部以AlO2-形式存在于溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeC12溶液中 ②过量NaOH溶液和明矾溶液馄合 ③少量Ca (OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中通入过量CO2 ⑤向饱和Na2CO3溶液中通入过量CO2
A.①②③④⑤ B.只有①④ C.只有②③ D.只有③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.一定条件下,2molSO2和1molO2混合在密闭容器中
充分反应后容器中的分子数大于2NA
B.256g S8分子中含S-S键为7NA个
C.由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D.1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com