
| A、气体分子的数目和分子本身的大小 |
| B、气体分子的质量和分子本身的大小 |
| C、气体分子的数目和分子间的平均距离 |
| D、气体分子本身的大小和分子间的平均距离 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、3.4g NH3中含有N-H键数为0.2NA |
| B、100mL 1mol?L-1氨水中,含有OH-离子数为0.1NA |
| C、100mL 2mol?L-1碳酸钠溶液中,Na+离子数为0.4NA |
| D、一定条件下,密闭容器充入1mol N2和3mol H2充分反应,转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐 |
| B、已知室温时,0.1mol?L-1某一元酸HA的电离平衡常数为1×10-7,则该酸的电离度约为0.01% |
| C、0.02mol?L-1CH3COOH溶液和0.01mol?L-1NaOH溶液等体积混合,则溶液中:2c(H+)+c(CH3COOH)=2c(OH-)+c(CH3COO-) |
| D、在温度不变的条件下向CaSO4饱和溶液中加入Na2SO4溶液,CaSO4将会析出,但Ksp不会发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、装饰材料释放的苯、甲苯、甲醛等易挥发性烃类物质会导致室内空气污染 |
| B、塑化剂是一种应用很广的化工塑料软化剂,可大量添加到婴幼儿玩具中 |
| C、PM 2.5亦称可入肺颗粒物,表面积大,能吸附有毒有害物质 |
| D、汽油标准已由“国Ⅲ”提到“国Ⅳ”,这意味着汽车不再排放氮氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
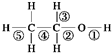
| A、乙醇和钠反应,键①断裂 |
| B、在Ag催化下和O2反应,键①③断裂 |
| C、乙醇和浓H2SO4共热140℃时,键①或键②断裂;在170℃时,键②⑤断裂 |
| D、乙醇完全燃烧时断裂键①② |
查看答案和解析>>
科目:高中化学 来源: 题型:
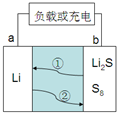 电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类(
电子产品小型化、微型化、集成化是当今世界技术发展的大势所趋,对锂离子二次电池提出了更高比容量的要求,锂硫电池的理论能量密度为是锂离子二次电池的3-5倍,是极具应用前景的电化学储能体系,近年来引起了研究人员的广泛关注.锂硫电池常用有机溶剂碳酸酯类( )作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )
)作为电解质溶液,放电时某极的电极反应式为:S+2Li+2e-═Li2S,电池如图所示:图中①②曲线为Li+移动方向.以下说法不正确的是( )| A、放电时Li+移动方向与曲线①一致 |
| B、电解质溶液不能用醋酸溶液代替碳酸酯类 |
| C、充电时阴极反应式:Li++e-═Li |
| D、充电时b电极接电源的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:
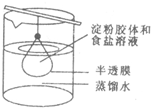 将10mL淀粉溶液和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )
将10mL淀粉溶液和5mL氯化钠溶液混合后,放入用半透膜制成的袋内,将此袋浸入蒸馏水中(如图),2min后分别取袋内和烧杯内液体进行实验.下列说法正确的是( )| A、用激光笔照射该烧杯中的液体,会产生丁达尔现象 |
| B、烧杯内液体加入碘水后呈蓝色 |
| C、该淀粉胶体在催化剂作用下可水解生成葡萄糖和果糖 |
| D、将烧杯中液体蒸干,得到的固体物质可用来制取纯碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠可以保存在煤油或酒精中,防止在空气中变质 |
| B、石油的裂化和煤的干馏,都属于化学变化 |
| C、等质量的葡萄糖和果糖在人体内完全氧化释放的能量相等 |
| D、聚氯乙烯制品易造成白色污染,可采用焚烧法处理 |
查看答案和解析>>
科目:高中化学 来源: 题型:
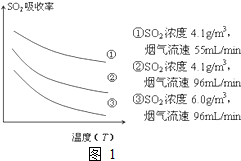 火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境.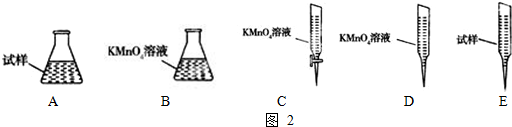
| 滴定次数 | 待测溶液 的体积/mL |
标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com