
【题目】为验证氧化性Cl2>Fe3+> SO2,某小组用下图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验)。
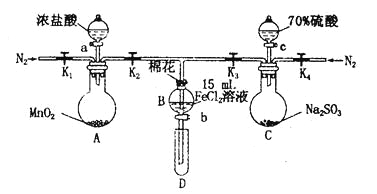
实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4。
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热。
Ⅲ.当B中溶液变黄时,停止加热,关闭K2。
Ⅳ.打开活塞b,使约2 mL的溶液流入D试管中,检验其中的离子。
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3。
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子。
(1)过程I的目的是____。
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式____ 。
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式____。
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为________。
(5)甲、乙、丙三位同学分别完成了上述实验,结论如下表所示。他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是____(填“甲”、“乙”或“丙”)。
过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中 含有的离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
(6)将B中的FeCl2溶液换成100 mLFeBr2溶液并向其中通入1.12 LCl2(标准状况下),若溶液中有1/2的Br一被氧化成单质Br2,则原FeBr2溶液中FeBr2的物质的量浓度为____ mol/L。
【答案】(1)排出装置中的空气,防止干扰;
(2)3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)2Fe3++H2S═2Fe2++2H++S↓;
(4)2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4;
(5)甲;
(6)0.5
【解析】试题分析:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气,故答案为:排出装置中的空气,防止干扰;
(2)检验B中溶液是否还有Fe2+的方法,用二价铁与+3价铁元素的配合物溶液反应生成蓝色沉淀的离子方程式为:3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓,故答案为:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓;
(3)三价铁离子与硫化氢反应,生成硫沉淀、二价铁、水,离子方程式为:2Fe3++H2S═2Fe2++2H++S↓,故答案为:2Fe3++H2S═2Fe2++2H++S↓;
(4)SO2具有还原性,酸性高锰酸钾溶液具有强的氧化性,二者混合后可以发生氧化还原反应:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,使高锰酸钾褪色,故答案为:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,故答案为:甲;
(6)设FeBr2的物质的量浓度为c,由电子守恒可知, ![]() ×2×1=c×0.1L×(3-2)+c×0.1L×2×
×2×1=c×0.1L×(3-2)+c×0.1L×2×![]() ×(1-0),解得c=0.5mol/L,故答案为:0.5
×(1-0),解得c=0.5mol/L,故答案为:0.5


科目:高中化学 来源: 题型:
【题目】下列过程属于固氮的是( )
A. 氮气和镁反应生成氮化镁 B. 豆科作物根把含氮化合物转变为蛋白质
C. 植物从土壤中吸收含氮养料 D. 将氨气转化成各类铵态氮肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制造镁粉是将镁蒸气在气体中冷却.可作为冷却气体的是( )
①空气 ②CO2 ③Ar ④H2 ⑤N2.
A.①② B.②③ C.③④ D.④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学一选修5:有机化学基础】
某高聚物W和树脂X的合成路线如下:
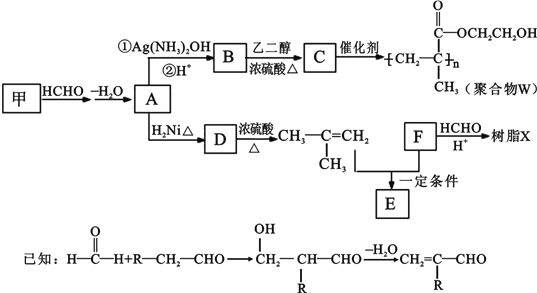
(1) A 的结构简式是_____。
(2) C中含氧官能团的名称是_____。
(3) D 的名称是_____。
(4) A→B 的第一步化学反应方程式是__
(5) 已知 F 的相对分子质量为 110,分子中碳原子、氢原子数都是氧原子数的 3 倍,苯环上的氢原子化学环境都相同,则 F 能发生的反应是(填字母)___。
a.加成反应 b.加聚反应 c.氧化反应 d.水解反应
(6) E 的分子式为 C10H14O2,含三个甲基,苯环上的一溴代物有两种。生成 E 的化学方程式是_____。
(7) B 有多种同分异构体。属于酯且含有碳碳双键的同分异构体共有__种(不考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关仪器的使用或操作正确的是( )
A. 烧杯、烧瓶、锥形瓶均可加垫石棉网加热
B. 试剂瓶可以用于存放、溶解、稀释药品
C. 用容量瓶配制溶液时,加入蒸馏水需要用玻璃棒引流,加至刻度线
D. 用滴定管量取液体时,开始读数和最后读数均俯视,则量取的体积准确
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图两瓶体积相等的气体,在同温同压时瓶内气体的关系一定正确的是( )
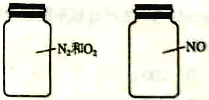
A. 所含原子数相等 B. 气体密度相等C.气体质量相等 D.摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用 63%的浓 HNO3 (其密度为 1.4 g·mL -1)配制 240 mL 0.50 mol·L-1 稀 HNO3,若实验仪器有:
A.10 mL 量筒 B.50 mL 量筒 C.托盘天平 D.玻璃棒 E.100 mL 容量瓶 F.250 mL 容量瓶 G.500 mL 容量瓶 H.胶头滴管 I.200mL 烧杯
(1)此浓硝酸的物质的量浓度为_____mol·L -1。
(2)应量取 63%的浓硝酸_____mL,应选用_____(填仪器的字母编号)。
(3)实验时还需选用的仪器有 D、I、______(填序号)。
(4)配制过程中,下列操作会使配制的稀硝酸溶液浓度偏高的是(填序号)______。
①量取浓硝酸的量筒用蒸馏水洗涤 2~3 次,并把洗涤液转入容量瓶
②容量瓶使用时未干燥
③溶解后未经冷却就移液
④定容时不小心有少量蒸馏水滴到瓶外
⑤定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[2017新课标Ⅰ]Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿(主要成分为FeTiO3,还含有少量MgO、SiO2等杂质)来制备,工艺流程如下:
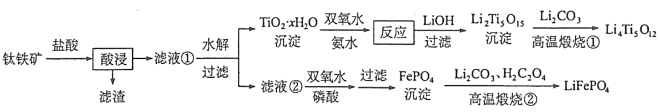
回答下列问题:
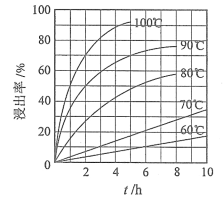
(1)“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为70%时,所采用的实验条件为___________________。
(2)“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式__________________。
形式存在,写出相应反应的离子方程式__________________。
(3)TiO2·xH2O沉淀与双氧水、氨水反应40 min所得实验结果如下表所示:
温度/℃ | 30 | 35 | 40 | 45 | 50 |
TiO2·xH2O转化率% | 92 | 95 | 97 | 93 | 88 |
分析40 ℃时TiO2·xH2O转化率最高的原因__________________。
(4)Li2Ti5O15中Ti的化合价为+4,其中过氧键的数目为__________________。
(5)若“滤液②”中![]() ,加入双氧水和磷酸(设溶液体积增加1倍),使
,加入双氧水和磷酸(设溶液体积增加1倍),使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为
,此时是否有Mg3(PO4)2沉淀生成? (列式计算)。FePO4、Mg3(PO4)2的Ksp分别为![]() 。
。
(6)写出“高温煅烧②”中由FePO4制备LiFePO4的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉放入由盐酸、MgCl2溶液、FeCl3溶液、CuCl2溶液组成的混合液中,充分反应后,铁粉有剩余,则溶液中含有的阳离子是( )
A.Cu2+和Fe2+ B.H+和Cu2+ C.Fe3+和Fe2+ D.Fe2+和Mg2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com