
【题目】取一定物质的量浓度的NaOH 溶液1 00mL,然后向其通入一定量的CO2气体,得到溶液A,向A中逐滴缓慢加入0.1mol/L的HCl溶液,产生的CO2气体体积(标准状况)与所加HCl溶液的体积之间关系如图所示,下列有关说法不正确的是( ) 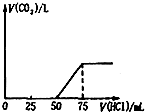
A.A溶液中溶质Na2CO3和NaHCO3物质的量比为l:l
B.A溶液中溶质NaOH和Na2CO3物质的量比为l:l
C.原Na0H 溶液物质的量浓度为0.075mol/L
D.通入CO2气体在标况下的体积为56mL
【答案】A
【解析】解:CO2与NaOH溶液反应有如下两种“边界”情况: CO2+2NaOH=Na2CO3+H2O…①CO2+NaOH=NaHCO3…②故反应后溶液中溶质的成分可有如下可能:Na2CO3和NaOH、Na2CO3、Na2CO3和NaHCO3、NaHCO3;当将稀盐酸逐滴滴到碳酸钠溶液中时,Na2CO3跟盐酸的反应是分步进行的: Na2CO3+HCl=NaHCO3+NaCl…③
NaHCO3+HCl=NaCl+H2O+CO2↑…④并且可以看出,当反应完全进行时,两个过程消耗HCl的量相等.若溶液中还有氢氧化钠,则首先发生反应:NaOH+HCl=NaCl+H2O…⑤设反应产生CO2 之前消耗盐酸的体积为V1 , 从开始产生CO2 至反应结束消耗盐酸的体积为V2 . 将各种反应的情况总结如下表:
溶液中溶质的成分 | Na2CO3和NaOH | Na2CO3 | Na2CO3和NaHCO3 | NaHCO3 | NaHCO3 |
向溶液中逐滴加入稀盐酸发生的反应 | 依次是⑤③④ | 依次是③④ | 依次是③④ | ④ | ④ |
V1与V2的关系 | V1>V2 | V1=V2 | V1<V2 | V1=0,V2>0 | V1=0,V2>0 |
分析题中的图象: A、V1=50mL,V2=75mL﹣50mL=25mL<V1 , 据此判断溶液中溶质的成分是Na2CO3和NaOH,根据上面⑤③④三个化学方程式可知,NaOH和Na2CO3的物质的量之比等于消耗盐酸的体积之比,则n(NaOH):n(Na2CO3)=(75mL﹣50mL):25mL=1:1,故A错误; B、溶液中溶质的成分是Na2CO3和NaOH,n(NaOH):n(Na2CO3)=(75mL﹣50mL):25mL=1:1,故B正确; C、当加入盐酸75mL时,溶液溶质为NaCl,此时n(Na+)=n(HCl)=0.075mL×0.1mol/L=0.0075mol,所以n(NaOH)=0.0075mol,c(NaOH)= ![]() =0.075mol/L,故C正确; D、50mL~75mL发生的反应为HCO3﹣+H+=H2O+CO2↑,n(HCl)=0.025L×0.1mol/L=0.0025mol,则V(CO2)=0.0025mol×22.4L/mol=0.056L=56mL,故D正确.故选A.
=0.075mol/L,故C正确; D、50mL~75mL发生的反应为HCO3﹣+H+=H2O+CO2↑,n(HCl)=0.025L×0.1mol/L=0.0025mol,则V(CO2)=0.0025mol×22.4L/mol=0.056L=56mL,故D正确.故选A.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:
【题目】室温时10mL某气态烃与过量氧气混合,完全燃烧后的产物通过浓硫酸,再恢复到室温,气体体积减少了30mL,剩余气体再通过苛性钠溶液,体积又减少了30mL.求气态烃的分子式及结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、一定条件下,RO3n-和氟气(F2)可发生如下反应:RO3n-+F2+2OH-===RO![]() +2F-+H2O,从而可知在RO3n-中,元素R的化合价是________
+2F-+H2O,从而可知在RO3n-中,元素R的化合价是________
Ⅱ、某同学写出以下三个化学方程式(未配平):
①NO+HNO3N2O3+H2O
②NH3+NOHNO2+H2O
③N2O4+H2OHNO3+HNO2
三个反应中,一定不可能实现的是______;在反应①中若消耗NO 15 g,转移电子______mol。
Ⅲ、已知Ix-和Cl2发生如下反应Ix- + Cl2 + H2O = Cl- + IO3- + H+若KIx(Ix-)与Cl2的系数之比为1∶8,则x值为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最新开发的一种新原理二次电池的能量密度是现行锂电池的7倍,该电池结构如图所示,下列有关说法正确的是( ) 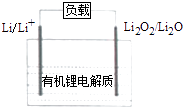
A.电池放电时Li+向负极移动
B.电池放电时,正极的电极反应式为:2Li++Li2O2+2e﹣═2Li2O
C.电池充电时,Li极应与外电源的正极相连
D.电池系统内进入二氧化碳及水对电池性能不会产生影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组化合物中,不论二者以任何比例混合,只要总质量一定,则完全燃烧时消耗O2的质量和生成水的质量不变的是( )
A.CH4、C2H6
B.C2H6、C3H6
C.C2H4、C3H6
D.C2H4、C3H4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaClO,NaClO3的混合液,经测定ClO﹣和ClO3﹣的浓度之比为1:3,则Cl2与NaOH溶液反应时被还原的氯原子与被氧化的氯原子的物质的量之比为( )
A.21:5
B.11:3
C.3:1
D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一份含有杂质MgCl2和KCl的AlCl3溶液M,某小组用下图所示过程对其进行除杂并尽可能的减少AlCl3的损失。请回答下列问题:
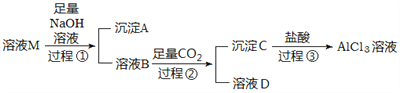
(1)沉淀A的化学式为__________,过程①中Al3+发生反应的离子方程式为__________________。
(2)氢氧化钠溶液_____(填“能”或“不能”)用氨水代替,原因是_____________________。
(3)溶液B中大量存在的阳离子是______________,过程②中生成沉淀C的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com