
| A. | 只有②⑥⑦ | B. | 只有⑦ | C. | ④⑤⑦ | D. | 全部 |
分析 ①难溶性的物质其饱和溶液的浓度很小;
②食盐水的饱和溶液中还可以继续溶解其它物质;
③搅拌可加快物质的溶解;
④固体物质的溶解度与温度有关;
⑤物质溶解时,扩散过程会吸收热量,水合过程会放出热量;
⑥溶液中溶质的量与溶液的体积有关;
⑦有晶体析出的饱和溶液中存在沉淀溶解平衡.
解答 解:①难溶性的物质其饱和溶液的浓度很小,如碳酸钙是难溶物质,其饱和溶液的浓度很小,故错误;
②食盐水的饱和溶液中还可以继续溶解其它物质,如饱和食盐水中可以继续溶解HCl,故错误;
③固体物质的溶解度与温度有关,搅拌并不能改变溶解度,搅拌可加快物质的溶解速度,故错误;
④固体物质的溶解度与温度有关,大部分固体物质的溶解度随温度的升高而增大,如NaCl,也有少量的固体的溶解度随着温度的升高而减小,如氢氧化钙,故正确;
⑤物质溶解时,扩散过程会吸收热量,水合过程会放出热量,浓硫酸溶于水放热,是因为其扩散时吸热小于水合时放热,故正确;
⑥溶液中溶质的量与溶液的体积有关,溶液的体积越大,溶解的溶质的量越多,如1L0.1mol/L的 NaOH溶液中含有的NaOH的质量大于0.001L1mol/L NaOH溶液中NaOH的质量,故错误;
⑦有晶体析出的饱和溶液中存在沉淀溶解平衡,所以在有晶体析出的饱和溶液中,既有溶解过程,也有结晶过程,两个过程的速率相同,故正确.
故选C.
点评 本题考查了物质的溶解性,题目难度不大,注意物质的溶解度与温度有关,侧重于考查学生的分析能力和对基础知识的应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:推断题
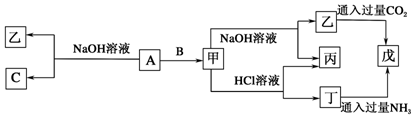
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
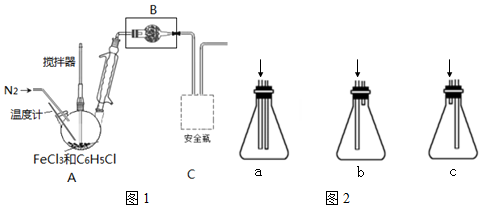
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的无色溶液:MnO4-、Na+、I-、Mg2+ | |
| B. | 含有0.1mol/L Fe3+的溶液中:Na+、Ca2+、SCN-、SO42- | |
| C. | 与铝片反应产生氢气的溶液:CO32-、SO42-、Na+、NH4+ | |
| D. | 使酚酞溶液变红的溶液:Na+、Cl-、NO3-、Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 60 mL 0.03 mol•L-1HCl溶液 | B. | 60 mL 0.04 mol•L-1KCl溶液 | ||
| C. | 20 mL 0.03 mol•L-1CaCl2溶液 | D. | 50 mL 0.05 mol•L-1AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当Al3+恰好完全沉淀时,消耗Ba(OH)22 mol | |
| B. | 当SO42-恰好完全沉淀时,Al3+全部转化为Al(OH)3 | |
| C. | 当向溶液中加入1.5mol Ba(OH)2时,反应可用下列离子方程式表示:2Al3++3 SO42-+3Ba2++6OH-═2Al(OH)3↓+3BaSO4↓ | |
| D. | 随着加入的Ba(OH)2的物质的量不断增大,沉淀的物质的量不断增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液(FeCl2):通入适量Cl2 | |
| B. | Fe2O3固体(Al2O3):加入烧碱溶液,过滤 | |
| C. | Cl2气体(HCl):通过NaOH溶液洗气后干燥 | |
| D. | Na2CO3固体(NaHCO3):加热 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com