
常温时,某溶液中由水电离出的H+和OH-的物质的量浓度的乘积为1×10-10,则该溶液可能是 ( )。
①H2SO4;②CH3COOH;③NH4Cl;④KOH
⑤CH3COONa
A.①④⑤ B.③⑤
C.①②③ D.③
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
酚醛树脂可用苯酚和甲醛反应制得.实验室制备酚醛树脂时,在酸性条件下,苯酚过量制得酚醛树脂若不易取出,则可趁热时加入一些乙醇来取出酚醛树脂;在碱性条件下,苯酚过量时,若酚醛树脂不易取出时,用加热或加溶剂的方法都很难将酚醛树脂取出.在上述两种情况下,下列有关叙述正确的是( )
|
| A. | 酸性条件制得的是体型结构酚醛树脂,碱性条件制得的是线型结构酚醛树脂 |
|
| B. | 酸性条件制得的是线型结构酚醛树脂,碱性条件制得的是网状结构酚醛树脂 |
|
| C. | 两种条件下制得的都是线型结构的酚醛树脂 |
|
| D. | 两种条件下制得的都是网状结构酚醛树脂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 mol•L-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是
(结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或 “不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。
 |
实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
① 此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
② 若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果 (填“偏高”“偏低”或“不变”)。
③ 产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目:高中化学 来源: 题型:
为实现中国2000年消除碘缺乏病的目标,卫生部规定食盐必须加碘,其中碘以碘酸钾(KIO3)形式存在, 已知在溶液中IO-3可和I-发生反应:IO-3+5I-+6H+=3I2+3H2O,根据此反应,可用试纸和一些生活中常见物质进行实验,证明食盐中存在IO-3,可供选用的物质有:①自来水,②蓝色石蕊试纸,③碘化钾 淀粉试纸,④淀粉,⑤食糖,⑥食用白醋,⑦白酒进行上述实验时必须使用的物质是 ( )
A.③⑥ B.①③
C.①②④⑤⑦ D. ②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
第三周期第IVA族的元素原子序数是:
Na元素的原子序数为11,相邻的同族元素的原子序数是:
短周期元素中,族序数=周期序数的元素有:
族序数等于周期序数2倍的元素有:
周期序数=族序数2倍的有:
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,0.1 mol·L-1的三种盐溶液NaX、NaY、NaZ的pH分别为7、8、9,则下列判断中正确的是 ( )。
A.HX、HY、HZ的酸性依次增强
B.离子浓度:c(Z-)>c(Y-)>c(X-)
C.电离常数:K(HZ)>K(HY)
D.c(X-)=c(Y-)+c(HY)=c(Z-)+c(HZ)
查看答案和解析>>
科目:高中化学 来源: 题型:
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品中;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
(1)NH4Al(SO4)2可作净水剂,其理由是_________________________________
______________(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1NH4Al(SO4)2中c(NH )________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1NH4HSO4中c(NH )。
)。
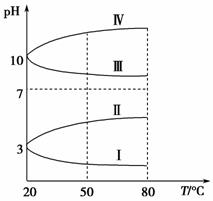
(3)如图是0.1 mol·L-1电解质溶液的pH随温度变化的图像。
①其中符合0.1 mol·L-1NH4Al(SO4)2的pH随温度变化的曲线是________(填写序号),导致pH随温度变化的原因是________________________________;
②20 ℃时,0.1 mol·L-1NH4Al(SO4)2中2c(SO )-c(NH
)-c(NH )-3c(Al3+)=________。
)-3c(Al3+)=________。
(4)室温时,向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示:
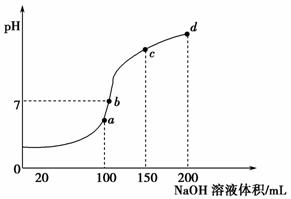
试分析图中a、b、c、d四个点,水的电离程度最大的是____________;在b点,溶液中各离子浓度由大到小的排列顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
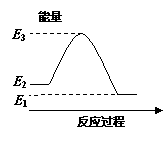
.反应X(g)+Y(g)  2Z(g) ΔH<0,达到平衡时,下列说法正确的是
2Z(g) ΔH<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是( )
A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗
B.酸式滴定管用蒸馏水洗后,用标准盐酸润洗
C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失
D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com