
| A. | 淀粉水解的最终产物是麦芽糖 | |
| B. | 丙烯分子中三个碳原子处于同一直线上 | |
| C. | 二氯甲烷只有一种结构,可证明甲烷是正四面体构型 | |
| D. | 符合分子式为C4H10O能与金属钠反应的有机物有3种 |
分析 A.淀粉水解的最终产物是葡萄糖;
B.丙烯分子中含有3个C,键角为120°;
C.甲烷若是正四面体,则二氯甲烷只有一种结构,因为正四面体的两个顶点总是相邻关系;
D.分子式为C4H10O并能与金属钠反应放出氢气,则该有机物属于醇,可以可知丁烷中的1个H原子被1个羟基取代产物,书写丁烷的同分异构体,根据等效氢判断丁醇的同分异构体数目.
解答 解:A.淀粉水解的最终产物是葡萄糖,麦芽糖不是最终水解产物,故A错误;
B.丙烯分子中含有3个C,键角为120°,则三个碳原子不处于同一直线上,故B错误;
C.CH4分子中有四个等同的CH键,可能有两种对称的结构:正四面体结构和平面正方形结构,但若是平面结构,二氯甲烷会有两种结构,故二氯甲烷只有一种结构,说明甲烷不是平面结构,只能是正四面体结构,故C正确;
D.分子式为C4H10O并能与金属钠反应放出氢气,则该有机物属于醇,可以可知丁烷中的1个H原子被羟基取代产物,丁烷有CH3CH2CH2CH3、CH3CH(CH3)CH3,
CH3CH2CH2CH3中有2种H原子,1个H原子被1个羟基取代有2种结构,
CH3CH(CH3)CH3中有2种H原子,1个H原子被1个羟基取代有2种结构,
故符合条件的C4H10O结构共有4种,故D错误.
故选C.
点评 本题考查有机物的结构与性质,为高频考点,侧重于学生的分析能力的考查,明确有机物的结构及官能团是解答本题的关键,注意加聚反应产物的判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
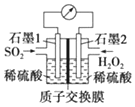 正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.
正确认识和使用电池有利于我们每一个人的日常生活.电化学处理 SO2 是目前 研究的热点,利用双氧水氧化吸收 SO2 是目前研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
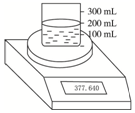 如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:
如图所示测定Na2O2(含Na2O杂质)纯度的实验装置,不同时间电子天平的读数如列表所示:| 实验操作 | 时间/s | 电子天平读数/g |
| 烧杯+水 | 370.000 | |
| 烧杯+水+样品 | 0 | 377.640 |
| 30 | 376.920 | |
| 60 | 376.400 | |
| 90 | 376.200 | |
| 120 | 376.200 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
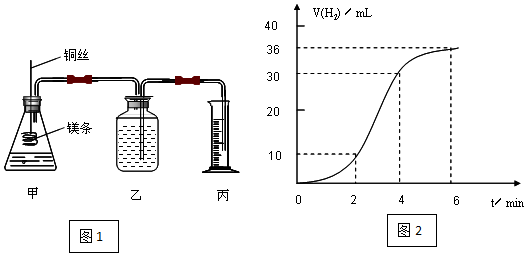
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
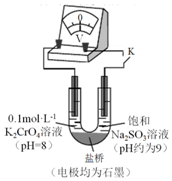 为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:
为探究Na2SO3溶液和铬(VI)盐溶液的反应规律,某同学进行实验如下:| 序号 | 操作 | 现象 |
| i | 向2mL pH=2的0.05mol•L-1 K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH 约为 9)3滴 | 溶液变绿色(含Cr3+) |
| ii | 向2mL pH=8的0.1mol•L-1 K2CrO4黄色溶液中 滴加饱和Na2SO3溶液3滴 | 溶液没有明显变化 |
| 序号 | 操作 | 现象 |
| iii | 向2mL饱和Na2SO3溶液中滴加pH=2的0.05mol•L-1 K2Cr2O7橙色溶液3滴 | 溶液变黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L1mol•L-1的FeCl3溶液中Fe3+的数目为NA | |
| B. | 32g甲烷中含有2NA个C-H键 | |
| C. | 1molNH2-含有10NA个电子 | |
| D. | 1molNa2O2与足量CO2反应.转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
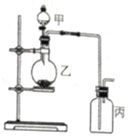 利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )
利用如图所示装置进行实验,能实现实验目的是(必要时可加热)( )| 选项 | 实验目的 | 甲 | 乙 | 丙 |
| A | 制取并收集NO2 | 浓硝酸 | 铜片 | 水 |
| B | 制取并验证SO2具有漂白性 | 70%硫酸 | 亚硫酸钠 | 品红溶液 |
| C | 制取并验证氯气没有漂白性 | 浓盐酸 | 二氧化锰 | 干燥的红布条 |
| D | 比较HCl、H2CO3和H2SiO3酸性的强弱 | 盐酸 | 大理石 | 硅酸钠溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
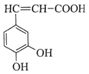 咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中.咖 啡酸有止血作用,特别对内脏的止血效果较好.A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式C6H5CH(COOH)2.
咖啡酸(如图)存在于野胡萝卜、光叶水苏、荞麦等物中.咖 啡酸有止血作用,特别对内脏的止血效果较好.A是咖啡酸的同分异构体,其苯环上只有1个取代基,1molA能与2molNaHCO3反应,A的结构简式C6H5CH(COOH)2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com