
分析 ①固体颗粒物的排放可导致雾霾发生;
②正常雨水的pH约为5.6,溶解二氧化硫的雨水的酸性增强,为酸雨,燃煤时加碳酸钙或CaO,与二氧化硫反应,减少其排放;
③ClO2具有强氧化性,Al3+水解生成胶体,胶体可吸附水中悬浮杂质.
解答 解:①固体颗粒物的排放可导致雾霾发生,只有d符合,a可导致酸雨,b可导致酸雨或光化学烟雾,c可导致温室效应,
故答案为:d;
②正常雨水的pH约为5.6,溶解二氧化硫的雨水的酸性增强,为酸雨,pH<5.6;燃煤时加碳酸钙或CaO,与二氧化硫反应,减少其排放,减少酸雨发生,
故答案为:<;CaCO3或CaO;
③天然水中杂质较多,常需加入ClO2,明矾等物质处理后才能饮用.加入ClO2的作用是杀菌消毒;加入明矾后,Al3+水解的离子方程式是Al3++3H2O?Al(OH)3(胶体)+3H+,故答案为:杀菌消毒;Al3++3H2O?Al(OH)3(胶体)+3H+.
点评 本题考查三废处理及环境保护,为高频考点,把握环境污染物及环境问题、化学与生活的关系为解答的关键,侧重分析与应用能力的考查,注意性质与用途及物质的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中通入少量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 氯化铁溶液吸收有毒的硫化氢气体:Fe3++H2S=2Fe2++S↓+2H+ | |
| C. | SO2通入Ba(NO3)2溶液中有白色沉淀:SO2+Ba2++H2O═BaSO3↓+2H+ | |
| D. | 84消毒液和洁厕灵混合使用会产生有毒气体:5Cl-+ClO3-+6H+═3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①可能为Al O2-+H++H2O=Al(OH)3↓ | B. | ①可能为Fe+2Fe3+=3Fe2+ | ||
| C. | ②可能为2NO+O2=2NO2 | D. | ②可能为Na2CO3+H2O+CO2=2NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
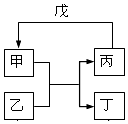 下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)( )
下列各组物质中,不满足如图所示转化关系的是(反应条件略去,箭头表示一步转化)( )| 选项 | 甲 | 乙 | 丙 | 戊 |
| A | NH3 | Cl2 | N2 | H2 |
| B | C | SiO2 | CO | CuO |
| C | Al(OH)3 | NaOH | NaAlO2 | CO2 |
| D | Br2 | FeI2 | FeBr2 | Cl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol•L-1的甲酸溶液的c(H+)约为0.01 mol•L-1 | |
| B. | 甲酸与水以任意比例互溶 | |
| C. | 10 mL 1 mol•L-1甲酸恰好与10 mL 1 mol•L-1NaOH溶液完全反应 | |
| D. | 甲酸的导电性很强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com