
| A、向NH4Al(SO4)2溶液中滴入Ba(OH)2溶液恰好使SO42-完全沉淀:Ba2++NH4++Al3++SO42-+4OH-═Al(OH)3↓+NH3?H2O+BaSO4↓ |
| B、KMnO4和H2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=2Mn2++4O2↑+6H2O |
| C、在电解质溶液为氢氧化钾的甲醇燃料电池内电路中,负极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O |
| D、向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32- |


科目:高中化学 来源: 题型:
| A | 第二周期中一种非金属元素,第一电离能大于相邻元素 |
| B | 2P轨道上有二个孤电子 |
| C | 与B同主族 |
| D | 前四周期中金属性最强的元素 |
| E | 前四周期中原子核外孤电子数最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、28 g C2H4中含有2 NA个碳原子 |
| B、常温常压下,22.4L氦气含有的原子数为2NA |
| C、1mol S在足量O2中燃烧,转移的电子数为6 NA |
| D、0.1 mol?L-1的碳酸氢钠溶液中含钠离子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、验证SO2具有氧化性:SO2气体通入酸性KMnO4溶液中 |
| B、从含I-的溶液中提取碘:加入适量稀硫酸与3%的H2O2溶液,再用酒精萃取 |
| C、测定中和热:取50mL5mol/L的硫酸和50mL5mol/LNaOH中和,测定反应放出的热 |
| D、除去Mg(OH)2中的少量Ca(OH)2:加入足量的MgCl2溶液,充分反应后过滤洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将此溶液稀释106倍,溶液的pH=6 |
| B、与等体积等浓度的氯化铵溶液混合后所得溶液呈中性 |
| C、与pH=2的CH3COOH溶液任意比混合:c(H+)+c(Na+)=c(OH-)+c(CH3COO-) |
| D、与0.01 mol?L-1 的CH3COOH溶液等体积混合所得溶液中:c (Na+)>c(CH3COO-)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| ||
B、
| ||
C、
| ||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| A、由重晶石制备高纯BaSO4只需经过两步化学反应 | ||||
B、反应C(g)+CO2(g)
| ||||
| C、实际生产中必须加入过量的炭使BaSO4得到充分的还原,同时还要通入空气,因为①②为吸热反应,炭和氧气反应放热维持反应所需高温 | ||||
| D、以BaS作为沉淀剂,用于铅和汞沉淀的转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
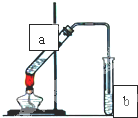 (Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.
(Ⅰ)(石油是现代工业的血液,乙烯的年产量可以衡量一个国家石油化工发展水平.请回答下列问题.| 催化剂 |
| Ⅰ |
| Ⅱ |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:
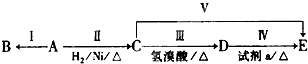
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com