
| A. | 0.5mol/L | B. | 0.01mol/L | C. | 0.02mol/L | D. | 0.05mol/L |
 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案科目:高中化学 来源: 题型:解答题
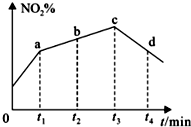 研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:
研究氧化物与悬浮在大气中的海盐粒子的相互作用时,涉及如下反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸的摩尔质量与6.02×1023个硫酸分子的质量在数值上相等 | |
| B. | 6.02×1023个N2和6.02×1023个H2的质量比等于14:1 | |
| C. | 1 mol臭氧和1.5 mol氧气含有相同数目的氧原子 | |
| D. | 常温、常压下,0.5×6.02×1023个一氧化碳分子质量是28 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保持容器容积不变,向其中再加入1mol H2,反应速率加快,理由是增大反应物氢气的浓度,反应速率加快 | |
| B. | 保持容器内气体压强不变,向其中加入1mol N2(N2不参加反应),反应速率减慢,理由是保持压强不变,向其中充入N2,体积变大,反应物浓度减小,反应速率减慢 | |
| C. | 保持容器容积不变,向其中加入1mol N2(N2不参加反应),反应速率不变,理由是反应物的浓度不变,反应速率不变 | |
| D. | 保持容器内气体压强不变,向其中再加入1mol H2(g)和1mol I2(g),反应速率减小,理由是容器体积变大反应物浓度变小,反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下液氨中c(NH4+)•c(NH2-)是一个常数 | |
| B. | 液氨中含有NH3、NH4+、NH2-等粒子 | |
| C. | 只要不加入其他物质,液氨中c(NH4+)=c(NH2-) | |
| D. | 液氨达到电离平衡时c(NH3)=c(NH4+)=c(NH2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4molA+2molB | B. | 3molC+1molB+1molD+1molA | ||
| C. | 2molA+1molB+1molD | D. | 1molA+0.5molB+1.5molC+0.5molD |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 起相同作用 | B. | 起不同作用 | ||
| C. | 只起氧化剂的作用 | D. | 只起还原剂的作用 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com