
铝及其化合物在生产生活中的应用广泛。
54.Al4C3用于冶金及催化剂。与盐酸反应(产物之一是含氢量最高的烃)的化学方程式是: ;14.4g Al4C3与盐酸反应产生的气体是 L(标准状况)。
55.AlN用于电子仪器。AlN中常混有少量碳,将一定量含杂质碳的AlN样品置于密闭反应器中,通入4.032L(标准状况下的)O2,在高温下充分反应后测得气体的密度为1.34g/L(已折算成标准状况,AlN不跟O2反应),则所得气体的摩尔质量为 g/mol,该气体的成分是 (写化学式),该样品中含杂质碳 g。
56.氯离子插层镁铝水滑石是一种新型的离子交换材料。制备这种水滑石的过程是:MgCl2、AlCl3、NaOH、NaCl溶液,按一定比例混合,在65℃充分反应后,经过滤、洗涤、干燥得到该水滑石。为确定该水滑石的成分,进行如下操作:
(1)取26.65g样品,在高温下使其充分分解,得到金属氧化物和气体,气体依次通过足量的浓硫酸和浓氢氧化钠溶液,这两种液体分别增重9.9g和3.65g;将金属氧化物在无色火焰上灼烧,火焰仍无色。
(2)另取26.65g样品,加入足量的稀硝酸,使其完全溶解,再加入NaOH溶液至过量,最终得到11.6g白色沉淀。通过计算确定氯离子插层镁铝水滑石的化学式。
57.氯离子插层镁铝水滑石在空气中放置,缓慢与CO2反应,部分氯离子会被碳酸根离子代替。26.65g样品在空气中放置一段时间后质量变为25.925g,则碳酸根离子代替部分氯离子的水滑石的化学式是 ,此过程的化学方程式 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
| 物质 | 甲醇 | 苯甲酸 | 苯甲酸甲酯 |
| 沸点/℃ | 64.7 | 249 | 199.6 |
Ⅰ.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g苯甲酸和20ml甲醇(密度约0.79g·mL-1 ),再小心加入3mL浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。‘
(1)浓硫酸的作用是 ;
简述混合液体时最后加入浓硫酸的理由: 。
(2)甲、乙、丙三位同学分别设计了如下图三套实验室合成苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用 装置(填“甲”或“乙”或“丙”)。

Ⅱ.粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制,请根据流程图写出操作方法的名称。操作Ⅰ 操作Ⅱ 。

(4)能否用NaOH溶液代替饱和碳酸钠溶液? (填“能”或“否”),
并简述原因 。
(5)通过计算,苯甲酸甲酯的产率是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是A、B、C、D、E五种有机物的有关信息:
| A | ①能使溴的四氯化碳溶液褪色;
②比例模型为 ③能与水在一定条件下反应生成C | |||
| B |
②球棍模型为 | |||
| C | ①由C、H、O三种元素组成; ②能与Na反应; ③与E反应生成相对分子质量为88的酯 | |||
| D | ①相对分子质量比C多18.5; ②在不同条件下, D能生成A,也能生成C | |||
| E | ①由C、H、O三种元素组成; ②其水溶液能使紫色石蕊试液变红 |
回答下列问题:
(1)A~E中,属于烃的是___________(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为_______________。
(3)写出D生成A的化学方程式_________________________________。
(4)有机物B具有的性质是__________ (填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计一个实验来比较E与碳酸酸性的强弱,则该实验的原理是________________________
(用化学方程式说明)。
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种化合物0.1mol/L的溶液,它们的阳离子有K+、Ag+、Ba2+、Fe2+、Al3+,阴离子有Cl-、OH-、NO3-、SO42-、CO32-,将它们进行如下实验:①溶液A、D呈碱性,且碱性为A>D;②向B溶液中滴加稀氨水至过量,先出现沉淀,后沉淀消失;③向E溶液中滴加氨水,生成白色沉淀,沉淀最终变为红褐色
A.实验①能确定A和D的化学式 B.实验②能确定B中含Al3+
C.实验③能确定E的化学式 D.上述实验能确定这五种化合物的化学式
查看答案和解析>>
科目:高中化学 来源: 题型:
 活性炭吸附法是工业提碘的主要方法之一。其流程如下:
活性炭吸附法是工业提碘的主要方法之一。其流程如下:
完成下列填空:
28.酸性条件下,NaNO2溶液只能将 I-氧化为I2,同时生成NO。写出反应①的离子方程式并标出电子转移的数目和方向 。
29.氯气、浓硝酸、酸性高锰酸钾等都是常用的强氧化剂,但工业上氧化卤水中I-选择了价格并不便宜的亚硝酸钠,可能的原因是什么? 。
30.反应②发生时,溶液底部有紫黑色的固体生成,有时溶液上方产生紫色的气体。解释产生这种现象的原因 ,所以,反应②需要在 条件下进行。
31.流程中,碘元素经过了I2→I-、IO3-→I2的变化过程,这样反复的原因是 。
32.流程中用到的NaHSO3溶液显弱酸性。是因为该溶液中存在以下的平衡:
①HSO3– + H2O H2SO3 + OH– 和 ② (写出离子方程式)
H2SO3 + OH– 和 ② (写出离子方程式)
向0.1mol/L的NaHSO3溶液中分别加入以下物质,回答问题:
a.加入少量金属Na,平衡①如何移动? 溶液的pH如何变化?
b.加入氨水至中性,则式子:c(Na+) = c(SO32–)+ c(HSO3–)+ c(H2SO3)>c(H+) = c(OH–),是否正确 ,解释原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各装置图的叙述中,不正确的是
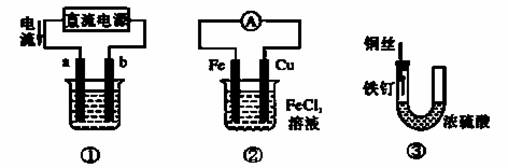
A.用装置①精炼铜,则a极为粗铜,电解质溶液为CuSO4溶液
B.用装置①进行电镀,镀件接在b极上
C.装置②的总反应是:Cu+2Fe3+===Cu2++2Fe2+
D.装置③中的铁钉几乎没被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
已知水的电离方程式:H2O  H+ + OH-。下列叙述中,正确的是
H+ + OH-。下列叙述中,正确的是
A.升高温度,KW增大,pH不变
B.向水中加入氨水,平衡向逆反应方向移动,c(OH-)降低
C.向水中加入少量硫酸,c(H+)增大,KW不变
D.向水中加入少量固体CH3COONa,平衡向逆反应方向移动,c(H+)降低
查看答案和解析>>
科目:高中化学 来源: 题型:
向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
| 操作 | 现象 | 结论 | |
| A | 滴加BaCl2溶液 | 生成白色沉淀 | 原溶液中有SO42- |
| B | 滴加氯水和CCl4,振荡、静置 | 下层溶液显紫色 | 原溶液中有I- |
| C | 滴加稀NaOH溶液,将湿润红色石蕊试纸置于试管口 | 试纸不变蓝 | 原溶液中无NH4+ |
| D | 加入稀盐酸,将产生的气体通入澄清石灰水中 | 溶液变浑浊 | 原溶液中一定含有CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
以电石渣(主要成分是Ca(OH)2,含SiO2以及其它少量杂质)为原料生产氯酸钾联合生产碳酸钙的流程如下:

回答下列问题:
电石渣溶于水形成电石渣浆时发生的主要反应的化学方程式为: 氯化过程的温度控制在75~80℃,该过程主要反应的离子方程式为: _______________________________________________________________ 该流程中加入活性炭的作用是
碳化过程中,先向溶液中通入氨气,再通入CO2。
①实验室通常采用加热氯化铵和氢氧化钙混合物的方法制取氨气。某学习小组选取下图所给部分装置制取并收集纯净的氨气。

如果按气流方向连接各仪器接口,你认为正确的顺序为a→ 、 → 、 →i。其中与i相连漏斗的作用是 。
②实验室中还可用固体氢氧化钠和浓氨水制取少量氨气,下列最适合完成该实验的简易装置是 (填编号)
 副产品A的化学式为 。
副产品A的化学式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com