
【题目】前四周期的元素A、B、C、D、E原子序数依次增大;A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态。请回答下列问题:
(1)E原子的电子排布式为________,C和D的第一电离能较大的是________。
(2)CO43-中C的杂化方式为________,该离子的“VSEPR”模型为________形。
(3)C和D的简单阴离子半径由大到小的顺序为________,C和D最高价含氧酸的酸性由弱到强的顺序为________。
(4)某分子的结构式为:A—B=B—A,则该分子中σ键和π键的数目之比为_____,B2分子和一氧化碳分子互为等电子体,则一氧化碳的电子式为_____。
(5)向EDO4溶液中加入过量稀氨水,阳离子化学式为________,该离子的配位体为________。
(6)B能量最高的电子为________轨道上的电子,其轨道呈________形。
【答案】[Ar]3d104s1或1s22s22p63s23p63d104s1 P sp3杂化 正四面体 P3->S2- H3PO4<H2SO4 3∶1 ![]() [Cu(NH3)4]2+ NH3 2p 纺锤形
[Cu(NH3)4]2+ NH3 2p 纺锤形
【解析】
前四周期元素A、B、C、D、E的原子序数依次增大,A是宇宙中含量最丰富的元素,则A为氢元素;B的L层电子数是K层电子数的2.5倍,则B元素原子L层电子数为5,可知B为N元素;B和C同一主族,D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应,故C为P元素、D为S元素;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态,原子核外电子排布式为1s22s22p63s23p63d104s1,故E为Cu元素。
由分析可知:A为H元素、B为N元素、C为P元素、D为S元素、E为Cu元素;
(1)Cu的核电荷数为29,基态Cu原子的电子排布式为[Ar]3d104s1或1s22s22p63s23p63d104s1;C、D分别为P、S,为同周期主族元素,自左而右第一电离能呈增大趋势,但P元素原子3p轨道为半充满电子构型,第一电离能高于同周期相邻元素的,故第一电离能由大到小的顺序是:P>S;
(2)PO43-中P原子孤电子对数=![]() =0,杂化轨道数目=0+4=4,故P原子的杂化方式为:Sp3杂化,P原子价层电子对数为4,该离子的“VSEPR”模型为正四面体形;
=0,杂化轨道数目=0+4=4,故P原子的杂化方式为:Sp3杂化,P原子价层电子对数为4,该离子的“VSEPR”模型为正四面体形;
(3)C、D分别为P、S,为同周期主族元素,随核电荷数增大,非金属性增强,P3-和S2-的离子结构相同,核电荷数大离子半径小,则简单阴离子P3-和S2-半径由大到小的顺序为P3->S2-,P和S最高价含氧酸的酸性由弱到强的顺序为H3PO4<H2SO4;
(4)由A为氢元素、N为氧元素,形成的分子的结构式为:H-N=N-H,单键为σ键,双键有1个σ键、1个π键,则该分子中σ键和π键的数目之比为3:1;N2分子中N原子之间存在三个共用电子对,N2分子和一氧化碳分子互为等电子体,结构相似,则一氧化碳的电子式为![]() ;
;
(5)向CuSO4溶液中加入过量稀氨水,得到的深蓝色溶液中阳离子化学式为:[Cu(NH3)4]2+,该离子的配位体为:NH3;
(6)B为氮元素,基态N原子的电子排布式为1s22s22p3,元素能量最高的电子为2p轨道上的电子,其轨道呈纺锤形。


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案科目:高中化学 来源: 题型:
【题目】可逆反应![]() ,在容积固定的密闭容器中达到平衡状态的标志是( )
,在容积固定的密闭容器中达到平衡状态的标志是( )
①单位时间内生成![]() 的同时生成
的同时生成![]()
②单位时间内生成![]() 的同时生成
的同时生成![]()
③用![]() 表示的反应速率之比为
表示的反应速率之比为![]() 的状态
的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的物质的量不再改变的状态
A.①④⑥⑦B.②③⑤⑦C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对古文献记载内容理解错误的是
A.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。“瓦”,传统无机非金属材料,主要成分为硅酸盐
B.《本草纲目》“烧酒”条目下写道:“自元时始创其法,用浓酒和槽入甑,蒸令气上![]() 其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
其清如水,味极浓烈,盖酒露也”。这里所用的“法”是指蒸馏
C.《本草经集注》有记载:“以火烧之、紫青烟起,乃真硝石也”,区分硝石(KNO3)和朴硝(Na2SO4),该方法利用了焰色反应
D.《开宝本草》中记载:“此即地霜也,所在山泽,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”。文中对硝酸钾提取涉及到升华操作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳中含有共价键总数为0.4NA
B.46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
C.1L1.0mol/L的盐酸中含有HCl分子数为NA
D.一定条件下,将2molSO2与1molO2充分反应,得到SO3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是重要的有机化工原料,利用乙烯进行如图转化
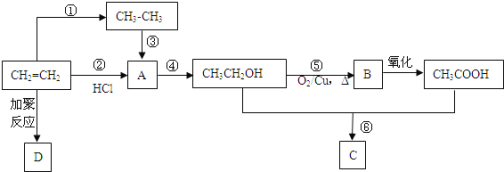
(1)乙醇分子中官能团的名称为____________,D的结构简式为_____________。
(2)实验室中用于鉴别乙烯和乙烷的试剂可选用______填序号。
A.水B.溴的四氯化碳溶液C.氢气D.酸性高锰酸钾溶液
(3)③的另一反应物及反应条件是______;通过途径②、③均可得到A,其中属于加成反应的是______填“②”或“③”。
(4)写出⑤、⑥的化学反应方程式:⑤______________________________、⑥________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化不能实现的是( )
A.Fe(s)![]() FeCl3(s)
FeCl3(s)![]() Fe(OH)3(s)
Fe(OH)3(s)
B.CaCl2(aq)![]() CaCO3(s)
CaCO3(s)![]() CaO(s)
CaO(s)
C.NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(s)
NaOH(s)
D.Al2O3(s)![]() AlCl3(aq)
AlCl3(aq) ![]() Al(OH)3 (s)
Al(OH)3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示装置从海水中提取CO2,有利于减少环境中温室气体的含量。下列说法正确的是
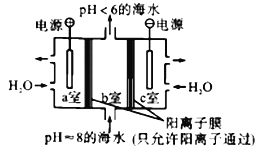
A. 通电后,a室的pH增大
B. 中间隔室发生的反应:HCO3-+H+==CO2↑+H2O,从而提取CO2
C. 阴极反应式为2H+-2e-==H2↑
D. 当电路中通过1mol电子的电量时,会有22.4LCO2气体产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期VA族元素,可以形成As2S3、H3AsO3、H3AsO4等化合物,用途广泛。
完成下列填空:
(1)砷原子核外有__个电子层,最外层有__个电子,写出砷原子最外层电子的轨道表示式:__。
(2)将砷与VA族所有短周期元素的原子半径,按从小到大的顺序排列:__(用元素符号表示)。
(3)溴位于VIIA族且与砷同周期,比较溴、砷最高价氧化物对应水化物酸性的强弱:__强于__(填物质的化学式)。
(4)周期表中,铝和砷都在金属和非金属过渡线附近,举一例说明铝元素具有非金属性:__。
(5)已知:稀Na3AsO3溶液、稀碘水和稀NaOH溶液混合,发生如下反应:AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
AsO43-(aq)+2I-(aq)+H2O(l),溶液中c(AsO43-)与反应时间(t)的关系如图所示。
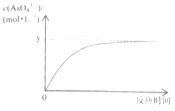
①写出该反应平衡常数的表达式K=___。
②不能判断反应达到平衡状态的是___(选填编号)。
A.溶液的pH不再变化
B.v(I-)=2v(AsO33-)
C.c(AsO33-)/c(I-)不再变化
D.c(I-)=2ymol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com