
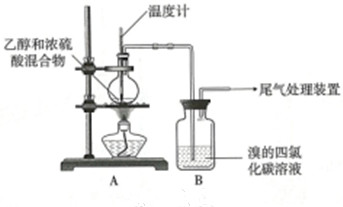
| 操作 | 现象 |
| 点燃酒精灯, 加热至170℃ | a.A中烧瓶内液体渐渐变黑 b.B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕 | c.A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
分析 (1)实验室制乙烯:乙醇和浓H2SO4共热至170℃制乙烯,乙醇发生消去反应,断裂碳氧键、与羟基所连的碳的相邻的碳上的碳氢键;浓硫酸具有脱水性、吸水性和强氧化性,会使乙醇碳化,所以可以看到黑色,能氧化乙醇,浓硫酸被还原产生了SO2;同时将乙醇中的氢和氧按水的组成脱去;
(2)给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应待溶液冷却后再补加,否则容易出现危险;
(3)①乙烯中的官能团为双键,能够和溴加成反应,溴的红棕色褪去;
②乙根据现象c认为产生了SO2,溴单质可以和二氧化硫发生氧化还原反应,生成硫酸和氢溴酸;
(4)①氢氧化钠可以和二氧化硫发生反应,吸收二氧化硫,排除二氧化硫的干扰,二氧化硫和氢氧化钠反应生成亚硫酸钠和水;
②溴单质可以和二氧化硫发生氧化还原反应,硫酸根离子和钡离子反应会生成白色沉淀.
解答 解:(1)实验室制乙烯:乙醇和浓H2SO4共热发生消去反应生成乙烯,原理方程式为:CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O,浓硫酸具有脱水性,能使乙醇中的氢和氧按水的组成脱去,溶液“渐渐变黑”,反应为:CH3CH2OH+4H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$4SO2↑+CO2↑+7H2O+C,同时浓硫酸表现强氧化性,
故答案为:CH3-CH2-OH $→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O;脱水性、强氧化;
(2)给液体加热加入沸石可以防止瀑沸,若加热后发现未加沸石,应待溶液冷却后再补加,否则容易出现危险,
故答案为:防止瀑沸;待溶液冷却后再补加;
(3)①根据甲的观点,溴水可以使B中溶液褪色,双键变单键,断键处加上加成试剂原子溴原子,反应的化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br;
②乙根据现象c认为产生了SO2,二氧化硫具有还原性,溴单质具有氧化性,在B中溴单质可以和二氧化硫发生氧化还原反应,反应的离子方程式为:SO2+Br2+2H2O=4H++2 Br-+SO42-,
故答案为:SO2+Br2+2H2O=4H++2 Br-+SO42-;
(4)①根据甲的设计,洗气瓶中盛放的试剂是氢氧化钠,可以和二氧化硫反应,吸收二氧化硫,排除二氧化硫的干扰,化学方程式为:SO2+2NaOH=Na2SO3+H2O,
故答案为:NaOH溶液;
②溴单质可以和二氧化硫发生氧化还原反应,生成硫酸根离子和溴离子,硫酸根离子和钡离子反应会生成白色沉淀,相关反应的离子方程式为SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓,
故答案为:SO2+2H2O+Br2═4H++2Br-+SO42-、SO42-+Ba2+═BaSO4↓或SO2+2H2O+Br2+Ba2+═4H++2Br-+BaSO4↓.
点评 本题考查学生乙醇的化学性质,充分考查学生的分析能力及灵活应用基础知识的能力,掌握反应原理、读取题干信息、正确书写方程式是解答关键,题目难度中等.


科目:高中化学 来源: 题型:填空题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a2<a3<a1<a4 | B. | a3=a2<a1<a4 | C. | a2=a3<a4<a1 | D. | a1<a2<a3<a4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题

| A. | 甲:醋酸;乙:纯碱;丙:苯酚钠溶液 证明酸性:CH3COOH>H2CO3>C6H5OH | |
| B. | 甲:10%过氧化氢溶液;乙:二氧化锰;丙:硫酸酸化的KI溶液 证明氧化性:O2>I2 | |
| C. | 甲:浓盐酸;乙:KMnO4 丙:KBr溶液 证明氧化性:KMnO4>Cl2>Br2 | |
| D. | 甲:饱和食盐水;乙:电石;丙:溴水 证明稳定性:H2O>C2H2>Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ③
③ ④
④ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4和Ba(OH)2 | B. | AlCl3和NaOH | C. | NaAlO2和H2SO4 | D. | Na2CO3和H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为NA | |
| C. | 1mol碳正离子CH5+所含的电子数为10NA | |
| D. | 0.5mol C3H8分子中含C-H共价键2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AlCl3溶液与烧碱溶液反应,当n(OH-):n(Al3+)=7:2时,2Al3++7OH-═Al(OH)3↓+AlO2-+2H2O | |
| B. | CuCl2溶液与NaHS溶液反应,当n(CuCl2):n(NaHS)=1:2时Cu2++2HS-═CuS↓+H2S↑ | |
| C. | Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时,2Fe2++4Br-+3Cl2═2 Fe3++2Br2+6Cl- | |
| D. | Fe与稀硝酸反应,当n(Fe):n(HNO3)=3:8时,3Fe+2NO3-+8H+═3Fe2++2NO↑+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com