
分析 (1)氰化钠易发生水解产生氰化氢;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,结合质量守恒书写化学方程式;
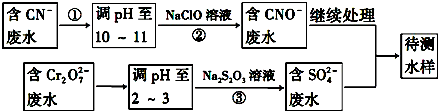
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
(1)从流程分析物质的转化关系和试剂选择分析所用方法;
(2)碱性条件下,CN-离子与NaClO发生氧化还原反应生成CNO-、Cl-离子,据此写出离子方程式;
(3)利用每0.4molCr2O72-转移2.4mol的电子来计算被还原后Cr元素的化合价,再书写离子方程式;
(4)根据氧化还原反应中得失电子数相等,再结合原子守恒进行计算.
解答 解:(1)氰化钠易发生水解产生氰化氢,方程式为CN-+H2O?HCN+OH-,故答案为:CN-+H2O?HCN+OH-;
(2)氰化钠与双氧水反应生成氨气和碳酸氢钠,方程式为NaCN+H2O2+H2O═NaHCO3+NH3↑,故答案为:NaCN+H2O2+H2O═NaHCO3+NH3↑;
(3)氰化钠遇到亚硝酸钠会生成两种气体发生爆炸,气体为二氧化碳和氮气,反应的方程式为3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O,故答案为:3NaCN+5NaNO2=3CO2↑+4N2↑+4Na2O;
(4)流程分析含CN-废水调整溶液PH加入NaClO溶液,氧化CN-离子反应生成CNO-的废水,含Cr2O72-的废水调整溶液PH加入Na2S2O3发生氧化还原反应得到含硫酸根离子的废水,和含CNO-的废水继续处理得当待测水样.
(1)从流程看,CN-转化为CNO-,化合价升高被氧化剂氧化,Cr2O72-转化为Cr3+化合价降低,故还原剂还原,故采用方法为氧化-还原法;
故答案为:d;
(2)步骤②中,无气体放出,CN-被ClO-氧化为CNO-,则因为是在碱性环境中,故ClO-只能被还原为Cl-,反应式为:CN-+ClO-═CNO-+Cl-;
故答案为:CN-+ClO-═CNO-+Cl-;
(3)每0.4molCr2O72-转移2.4mol的电子,设还原后Cr元素的化合价为x,则0.4mol×2×(6-x)=2.4mol,解得x=+3,则离子反应为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O,
故答案为:3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O;
(4)处理1mol Cr2O72-,需加入a mol FeSO4•7H2O,根据铬原子守恒得,1mol Cr2O72-完全反应后生成 $\frac{2}{2-x}$molFeⅡ[FeⅢx•CrⅢ2-x]O4,根据铁原子守恒得amol=$\frac{2(1+x)}{2-x}$mol①,该反应中得失电子数相等,1mol×2×3=$\frac{2}{2-x}$mol×(3-2)×x,解得x=1.5,将x=1.5代入①得a=10,
故答案为:D.
点评 本题考查物质的分离和提纯,为高频考点,涉及实验基本操作、氧化还原反应等知识点,明确流程图中化学反应原理、基本操作方法是解本题关键,难点是(4)的氧化还原反应的计算,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①②⑦ | B. | ②④⑥ | C. | ②③⑦ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | H2(g) | CO2(g) | CH2=CH2(g) | H2O(g) |
| 能量/kJ•mol-1 | 0 | -394 | 52 | -242 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素原子第一电离能大小关系:Z>Y>W>X>M | |
| B. | XZ2、X2M2、W2Z2均为直线形的共价化合物 | |
| C. | Y与M形成化合物键长大于Z与M形成化合物的键长 | |
| D. | 由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混合溶液中由水电离出来的c(OH-)=1×10-9mol/L | |
| B. | c(OH-)-c(HY)=c(H+)=1×10-5mol/L | |
| C. | 混合溶液中c(Na+)=c(Y-)+c(HY)=0.15mol/L | |
| D. | 混合溶液中离子浓度大小次序为:c(Y-)>c(Na+)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com