
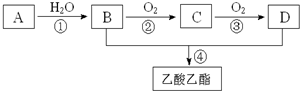
分析 A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,乙醇和乙酸发生酯化反应生成乙酸乙酯,所以D为CH3COOH,乙醇被催化氧化生成乙醛,乙醛被氧化生成乙酸,所以C为CH3CHO,据此分析解答.
解答 解:A的产量通常用来衡量一个国家的石油化工水平,则A为CH2=CH2,与水发生加成反应得到B为CH3CH2OH,乙醇和乙酸发生酯化反应生成乙酸乙酯,所以D为CH3COOH,乙醇被催化氧化生成乙醛,乙醛被氧化生成乙酸,所以C为CH3CHO,
(1)C为CH3CHO,D为CH3COOH,D中的官能团名称为羧基,
故答案为:CH3CHO;羧基;
(2)反应①为乙烯和水的加成反应,反应方程式为CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,
④为乙醇与乙酸的酯化反应,反应方程式为CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,
故答案为:CH2=CH2+H2O$\stackrel{一定条件下}{→}$CH3CH2OH,加成反应;CH3CH2OH+CH3COOH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O,酯化反应.
点评 本题考查有机物的推断,涉及烯、醇、醛、羧酸等的性质与转化等,难度不大,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
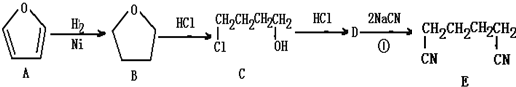
| A. | A→B的反应属于加成反应 | B. | B→C的反应属于酯化反应 | ||
| C. | C→D的反应属于消去反应 | D. | D→E的反应属于加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应速率可衡量化学反应的快慢 | |
| B. | 决定反应速率的主要因素是反应物的性质 | |
| C. | 增大反应物浓度、提高反应物温度都能增大反应速率 | |
| D. | 因是同一反应,所以用不同物质表示化学反应速率时,所得数值是相同的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的生成速率与C的分解速率相等 | |
| B. | 单位时间内生成nmolA的同时生成3nmol的B | |
| C. | A,B,C三种物质的浓度相等 | |
| D. | A,B,C的物质的量之比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池是将化学能转化为电能的装置 | |
| B. | 原电池负极发生氧化反应 | |
| C. | 原电池中,阳离子向负极移动 | |
| D. | 原电池电子流出的一极为负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮及其化合物与人类生产、生活息息相关.回答下列问题:
氮及其化合物与人类生产、生活息息相关.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com