
关于电解NaCl水溶液,下列叙述正确的是( )
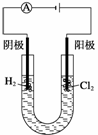
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
科目:高中化学 来源: 题型:
I、二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的 意义。
意义。
(1)工业上用黄铁矿(FeS2,其中S元素为-l价)在高温下和氧气反应制备SO2:
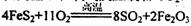 ,该反应中被氧化的元素是________(填元素符号)。
,该反应中被氧化的元素是________(填元素符号)。
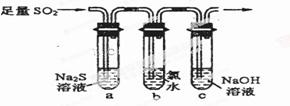
(2)一化学研究性学习小组设计用如下装置验证二氧化硫的化学性质.
①能说明二氧化硫具有氧化性的实验现象为________________________________。
②为验证二氧化硫的还原性 ,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
,充分反应后,取试管b中的溶液分成三份,分别进行如下实验:
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液加入BaC!:溶液,产生白色沉淀上述方案合理的是方案______(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子反应方程式为____________________。
③当通入二氧化硫至试管c中溶液显中性时,溶液中c(Na+)=________________(用含硫元素微粒浓度的代数式表示)。
Ⅱ、另一化学研究性学习小组在实验室条件下以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,并对阳极泥和电解液中金属进行回收和含量测定。已知粗铜中含有少量的锌、铁、银、金等金属和少量矿物杂质(与酸不反应)。
步骤一:电解精制:
电解时,粗铜应与电源的______极相连。阴极上的电极反应式为____________。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:
稀硝酸处理阳极泥得到硝酸银稀溶液,请写出该反应的离子方程式:
____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
对“AgCl(s)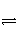
 Ag+(aq)+Cl-(aq)”的理解正确的是( )
Ag+(aq)+Cl-(aq)”的理解正确的是( )
①说明AgCl没有完全电离,AgCl是弱电解质
②说明溶解的AgCl已完全电离,是强电解质
③说明Cl-与Ag+的反应不能完全进行到底
④说明Cl-与Ag+的反应可以完全进行到底
A.③④ B.③ C.①③ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
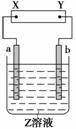
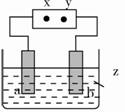
如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无味气体放出。符合这一情况的是附表中的( )
| a极板 | b极板 | X电极 | Z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
电解84.75 mL 16%的NaOH溶液(ρ=1.18 g·cm-3),用石墨作电极经过一段时间后溶液浓度为19.5%,这是因为( )
A.溶质增加了3.5 g
B.放出了22.4 L H2和11.2 L O2
C.NaOH比水消耗少
D.消耗18 g水
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )
A.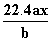 B.
B.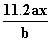 C.
C.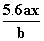 D.
D.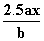
查看答案和解析>>
科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
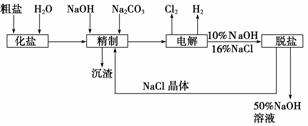
依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的电极反应式为________________________,与电源负极相连的电极附近,溶液pH________(选填“不变”、“升高”或“下降”)。
(2)工业食盐中含Ca2+、Mg2+等杂质,精制过程中除去这些杂质时发生反应的离子方程式为________________________________________________________________________、
________________________________________________________________________。
(3)如果粗盐中SO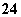 含量过高,必须添加钡试剂除去SO
含量过高,必须添加钡试剂除去SO ,该钡试剂可以是________(填写字母序号,下同)。
,该钡试剂可以是________(填写字母序号,下同)。
A.Ba(OH)2 B.Ba(NO3)2 C.BaCl2
(4)为有效除去Ca2+、Mg2+、SO ,加入试剂的合理顺序为________。
,加入试剂的合理顺序为________。
A.先加NaOH,后加Na2CO3,再加钡试剂
B.先加NaOH,后加钡试剂,再加Na2CO3
C.先加钡试剂,后加NaOH,再加Na2CO3
(5)脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过________、冷却、________
(填写操作名称)除去NaCl。
(6)用隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜法电解冷的食盐水时,Cl2与NaOH充分接触,得到的产物仅是NaClO和H2,则与该反应相应的化学方程式为________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
图中x、y分别是直流电源的两极,通电后发现a极板的质量增加,b极板处有无色、无臭气体放出,符合这一情况的是( )。
| a极板 | b极板 | x电极 | z溶液 | |
| A | 锌 | 石墨 | 负极 | CuSO4 |
| B | 石墨 | 石墨 | 负极 | NaOH |
| C | 银 | 铁 | 正极 | AgNO3 |
| D | 铜 | 石墨 | 负极 | CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,杠杆AB两端分别持有体积相同、质量相等的空心铜球和空心铁球,调节杠杆并使其在水中保持平衡,然后小心地向烧杯中央滴入较浓的硫酸铜溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑两球的浮力变化)( )

A.当杠杆为绝 缘体时,A端高、B端低;为导体时,A端低、B端高
缘体时,A端高、B端低;为导体时,A端低、B端高
B.当杠杆为绝缘体时,A端低、B端高;为导体时,A端高、B端低
C.当杠杆为导体或绝缘体时,均为A端高B端低
D.当杠杆为导体或绝缘体时,均为A端低B端高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com